1. Morfología
2. Fusión y fisión
3. Importe de proteínas
4. Funciones
- ATP
- Metabolismo
- Estrés
- Apoptosis
- Otras
5. Renovación
Las mitocondrias son orgánulos que aparecen en prácticamente todas las células eucariotas. Una excepción son los arqueozoos, eucariotas que no poseen mitocondrias, probablemente porque las perdieron durante la evolución. Las mitocondrias se reconocieron como una parte elemental de las células eucariotas a finales del siglo XIX. Altmann (1890) descubrió unas estructuras celulares que denominó bioblastos, que se podían teñir con fucsina, y que se observaban en todas las células eucariotas. En 1914 ya se sabía que las mitocondrias podían adoptar diferentes formas, como bastones, hilos o entramados. Con la llegada del microscopio electrónico se comprobó que estaban formadas por una doble membrana. En 1962 se propuso que las mitocondrias crecían en tamaño y posteriormente se dividían por fisión, con lo cual su morfología era cambiante. Hoy se sabe que las mitocondrias se fusionan y se dividen, y forman redes en las células. Actualmente hay sustancias fluorescentes que permiten estudiar la dinámica de las mitocondrias in vivo.
Las mitocondrias son orgánulos descendientes de alfa proteobacterias respiratorias ancestrales que se asociaron con derivados de arqueas, ambos tipos celulares son procariotas, para formar el linaje de las células eucariotas actuales. Así, se propone que las mitocondrias surgieron hace unos 2000 millones de años por endosimbiosis. Desde entonces han ido adquiriendo funciones importantes en la célula: son centrales energéticas de primer orden, participan en procesos metabólicos de síntesis y catálisis de moléculas, participan en las respuestas al estrés celular y apoptosis, e influyen en el destino de las células afectando a la diferenciación o supervivencia de la célula. Durante este periodo las mitocondrias han ido cediendo la mayor parte de sus genes originales al núcleo.
1. Morfología
La morfología de las mitocondrias es muy cambiante y puede variar desde largas estructuras ramificadas a pequeños elipsoides. Se podría decir que existen mitocondrias individudales, así como una red mitocondrial muy dinámica de la cual se pueden desgajar porciones. En red o aisladas, las mitocondrias están formadas por una membrana externa, una membrana interna, que se pliega formando las crestas mitocondriales, un espacio intermembranoso y un espacio interno delimitado por la membrana interna denominado matriz mitocondrial (Figuras 1 y 2).


La membrana mitocondrial externa es altamente permeable y contiene muchas copias de una proteína denominada porina, la cual forma canales acuosos a través de la bicapa lipídica. Así, esta membrana se convierte en una especie de tamiz que es permeable a todas las moléculas menores de 5000 daltons, incluyendo proteínas pequeñas.
Por el contrario, la membrana mitocondrial interna es muy impermeable al paso de iones y pequeñas moléculas. Las mitocondrias deben hacer de su membrana interna una barrera suficientemente impermeable como para permitir un gradiente de protones estable. Esto se podría conseguir con un incremento de colesterol, que aumenta la hidrofobicidad de la membrana, pero, sin embargo, disminuiría la fluidez. La membrana interna necesita fluidez e hidrofobicidad al mismo tiempo, lo que parece ser necesario para la función de esta membrana. Para ello las mitocondrias, contienen muy poco colesterol, pero cuentan con la cardiolipina, que es un fosfolípido muy insaturado, con lo que aumenta la hidrofobicidad evitando disminuir la fluidez. Por tanto, la matriz mitocondrial sólo contiene aquellas moléculas que puedan ser transportadas selectivamente por estas dos membranas, siendo su contenido altamente diferenciado del citosol.
Las membranas mitocondriales poseen una gran cantidad de fosfatidiletanolamina y fosfatidilcolina, además de la cardiolipina. Los tres lípidos de membrana se sintetizan en las mitocondrias, pero el resto de lípidos tienen que ser importados, fundamentalmente del retículo endoplasmático. Curiosamente, parte de la fosfatidiletanolamina del retículo endoplasmático proviene de la mitocondria. Esta transferencia de lípidos entre la mitocondria y el retículo endoplasmático se realiza en sitios de contacto físico entre ambos orgánulos, con la intervención de transportadores lipídicos. El 40 % de los lípidos de membrana de las mitocondrias son cardiolipina y fosfatidiletanolamina.
La membrana mitocondrial interna posee numerosos pliegues hacia el interior mitocondrial denominados crestas mitocondriales. El número y forma de las crestas mitocondriales se cree que es un reflejo de la actividad celular. Son muy dinámicos, pudiendo cambiar según la fisiología y el tipo celular. Hay tres tipos morfológicos de crestas: discoidales, tubulares y lamelares. Las crestas forman un compartimento distinto del resto de la membrana interna puesto que su contenido en proteínas es muy diferente. La formación, remodelación y organización final de las crestas depende de varios elementos: asociación de los dímeros de ATP sintasa, de proteínas relacionadas con las dinaminas, cambio en la composición de los lípidos de membrana, presencia de otras proteínas denominadas Mic que participan en la interacción de la membrana interna y la externa, y del grado de plegamiento de la membrana interna. La cardiolipina se concentra en aquellas regiones muy curvadas de las crestas. La forma molecular en forma de cuña de la cardiolipina podría ayudar en esta función.
Las crestas están conectadas entre sí por las regiones de la membrana interna próximas y paralelas a la membrana externa, denominadas regiones limitantes. Estas regiones limitantes son centros para el intercambio de lípidos, importación de proteínas, poseen proteínas para la fusión y fisión de las mitocondrias, y se produce el ensamblaje de los complejos de la cadena respiratoria. En las crestas se encuentran los complejos respiratorios funcionales y la ATP sintasa, además de las proteínas para el ensamblaje de los grupos sulfuro-hierro. La conexión entre las crestas y la región limitante está mediada por una región que forma un tubo muy delgado que limita el movimiento de las proteínas solubles intermembranosas. Las crestas son una manera de incrementar enormemente la superficie de membrana para el acomodo de las proteínas de la cadena respiratoria y de las ATPasas. En una célula hepática la membrana mitocondrial interna puede suponer 1/3 del total de las membranas celulares. La membrana externa y la interna están conectadas a través de complejos proteicos que se encuentran en sitios puntuales. De todos modos, parece que las crestas son relativamente independientes unas de otras y forman dominios separados en la mitocondria. Por ejemplo, pueden tener diferentes potenciales de membrana (gradiente de concentración de cargas a ambos lados de la membrana) incluso en la misma mitocondria.
En la matriz mitocondrial se encuentra el ADN, los ribosomas y los enzimas para llevar a cabo procesos metabólicos. El ADN mitocondrial se encuentra en lugares denominados nucleoides y cada nucleoide puede tener más de una molécula de ADN. El ADN se encuentra condensado por una proteína denominada TFAM. Los nucleoides están asociados a la membrana mitocondrial interna, mediada por el complejo proteico denominado MitOS. También en el nucleoide hay proteínas para la replicación y reparación del ADN mitocondrial. Éste suele tener unos 16500 pares de bases con unos 37 genes que en humanos codifican para 13 proteínas, que son componentes de la cadena respiratoria, 2 ARN ribosómicos y 22 ARN de transferencia, suficientes para llevar a cabo la síntesis de proteínas. Dentro de una célula puede haber cientos de copias del ADN mitocondrial. La replicación del ADN mitocondrial no está acoplada al ciclo celular y en cualquier momento de la vida de la célula puede haber replicación de este ADN. A veces se producen mutaciones en alguna molécula de ADN, pero no en otras, por lo que se da en la célula la posibilidad de que haya genomas mitocondriales diferentes, fenómeno que se llama heteroplasmia.
Las mitocondrias, o porciones de la red mitocondrial, son desplazadas desde unas partes de la célula a otras, tienen una extraordinaria movilidad y suelen localizarse donde existe más demanda de energía o de calcio (ver más abajo). Esto es especialmente importante en las neuronas, donde las mitocondrias se trasladan desde el soma hasta los lugares más distantes de las dendritas y axones, desde donde pueden volver al soma de nuevo. Los movimientos son saltatorios o discontinuos. Los desplazamientos de larga distancia están mediados por microtúbulos, mientras que los de corta distancia están mediados por los filamentos de actina. Aunque, a veces, tanto microtúbulos como filamentos de actina sirven también para su anclaje. En los axones, las velocidades de las mitocondrias a lo largo de los microtúbulos son 0,1 a 1,4 µm/s. Parece haber también un movimientos lento de 50 µm/h en axones en crecimiento.
Las mitocondrias se comunican entre sí por varios mecanismos como son la liberación de moléculas, contactos membrana membrana o por fusión/fisión total. También parece haber nanotúbulos que conectan temporalmente mitocondrias cercanas. Estos nanotúbulos conectan las matrices mitocondriales, por lo que están formados por una doble membrana, tienen entre 40 y 200 nm de diámetro y entre 1 y 30 µm de largo. Los nanatubúlos entre mitocondrias necesitan kinesina y microtúbulos para su formación. El estrés provocado por una mala regulación del calcio podría disparar la formación de nanoútúbulos y sólo se han observado en mitocondrias inmóviles.
2. Fusión y fisión
Las mitocondrias pueden dividirse y fusionarse entre sí con facilidad, y ocurre constantemente en las células, con la consiguiente mezcla de los ADN mitocondriales. Se puede decir que en las células eucariotas las mitocondrias pueden encontrarse de manera individual y también como una red mitocondrial conteniendo un número variable de moléculas de ADN. Si se fusionan dos células que tienen mitocondrias diferentes, la red de mitocondrias es homogénea en 8 horas. Estos procesos de fusión y fisión son complejos puesto que han de hacerlos las dos membranas mitocondriales de forma correcta. Por todo ello, el número de mitocondrias es difícil de saber. En algunos tipos celulares se ha visto que el aumento del volumen mitocondrial está relacionado con el del volumen celular.
Las posibles funciones de la fusión y fisión de las mitocondrias son compartir los productos sintetizados por distintas partes de la red, paliar defectos locales, o compartir el ADN mitocondrial. Hay muchas evidencias de que la fusión de las mitocondrias aumenta cuando la célula está en nivel de estrés medio y tiene un carácter protector. Por otro lado la fisión mitocondrial aumenta cuando hay un estrés agudo o cercano a la muerte celular. La protección por fusión parece basarse en dos aspectos: la fusión inhibe el inicio de la apoptosis y se crea un canal electroquímico en largas distancias que comunica la periferia celular con el interior. Además, mezcla metabolitos y proteínas mitocondriales amortiguando alteraciones locales. De cualquier manera, demasiada fusión es patológica. Bajo condiciones normales la fusión y la fisión están en equilibrio.
La división de las mitocondrias esta mediada por proteínas parecidas a las dinaminas (denominadas DRP) (Figura 3), que en el tráfico vesicular participan en la generación de vesículas. En las células de mamíferos, el punto por donde las mitocondrias se dividen depende de la interacción con el retículo endoplasmático. Antes de la división, y de atraer a las proteínas similares a la dinamina, las membranas del retículo rodean a la mitocondria, y se produce una constricción inicial mediada por los filamentos de actina. Los nucleoides se encuentran próximos a los lugares de división. La asociación del retículo puede ser para segregar apropiadamente los nucleoides durante las fisiones. Estos contactos sirven también para la transferencia de lípidos desde el retículo a la mitocondria, lo que es necesario para sintetizar algunos lípidos necesarios para la mitocondria como la fosfatidiletanolamina y la cardiolipina.

3. Importe de proteínas
Las mitocondrias tienen muy pocos genes comparado con la variedad de proteínas que poseen. Una mitocondria de levadura contiene aproximadamente unas 1000 proteínas diferentes, mientras que en humanos pueden ser unas 1500. Sólo una pequeña parte se sintetiza en la propia mitocondria. El resto ha de ser sintetizado en el citosol e importadas por la mitocondrias. Esto es consecuencia del trasvase de genes desde la mitocondria al genoma nuclear a lo largo de la evolución endosimbionte. Curiosamente, muchos complejos proteicos que forman la cadena de transporte de electrones en las crestas mitocondriales están formados tanto por proteínas que se codifican en el núcleo como de otras codificadas por la propia mitocondria. Por tanto, el núcleo y la mitocondria han de coordinar la expresión de tales genes. Durante el proceso de importación de proteínas desde el citosol han de dirigirse a su compartimento diana: membrana externa o interna, o matriz mitocondrial. Para ello las proteínas tienen secuencias que actúan como señales a modo de dirección postal, que indican a las moléculas importadoras a dónde deben dirigirlas.
4. Funciones
La función primaria de las mitocondrias es la producción de ATP, que es el combustible de la mayoría de los procesos celulares. Pero también llevan a cabo parte del metabolismo de los ácidos grasos mediante un proceso denominado β-oxidación y actúan como almacén de calcio, formación de grupos hemo, síntesis de aminoácido y biogénesis de grupos hierro-sulfuro. También se han relacionado a las mitocondrias con la apoptosis, el cáncer, el envejecimiento, y con enfermedades como el Parkinson o la diabetes, así como un orgánulo que participa en la respuesta inmune innata. Además, el estudio comparativo del ADN mitocondrial tiene una gran utilidad en el establecimiento de genealogías y en la antropología, ya que los genes mitocondriales provienen directamente por línea materna y no están sometidas a recombinaciones génicas debido a la reproducción sexual.
Producción de ATP
En las mitocondrias se produce la mayor parte del ATP de las células eucariotas no fotosintéticas. Metabolizan el acetil coenzima A mediante el ciclo enzimático del ácido cítrico, dando como productos al CO2 y al NADH. Es el NADH el que cede electrones a una cadena de transportadores de electrones que se encuentra en la membrana de las crestas mitocondriales. Estos electrones pasan de un transportador a otro llegando como último paso al O2, resultando H2O. Este transporte de electrones se acopla al transporte de protones desde la matriz hasta el espacio interno de las crestas. Es este gradiente de protones el que permite la síntesis de ATP gracias a la ATP sintasa. Por unir fosfato al ADP y por usar el oxígeno como aceptor final de electrones, a este proceso se le llama fosforilación oxidativa. En las bacterias aeróbicas, que no poseen mitocondrias, este proceso ocurre en su única membrana celular.
Las proteínas que realizan el transporte de electrones y la ATP sintasa se encuentran en las crestas mitocondriales, los pliegues de la membrana interna. Precisamente el confinamiento en estos pliegues es una manera de incrementar la plataforma en la que se asientan las proteínas de la fosforilación oxidativa y su eficiencia por encontrarse próximas. Existen múltiples copias tanto de proteínas transportadoras como de ATP sintasas, pudiendo llegar hasta el 80% del peso de la membrana mitocondrial.
La cadena transportadora de electrones se conoce como cadena respiratoria (Figura 4). Contiene unas 40 proteínas, de las cuales 15 participan directamente en el transporte de electrones. Todas estas proteínas se agrupan en tres complejos proteicos, cada uno de los cuales contiene varias proteínas. Se denominan: complejo de la NADH deshidrogenasa, complejo citocromo b-c1 y complejo de la citocromo oxidasa. Cada uno de ellos tiene grupos químicos que permiten el paso de protones a su través movidos por el transporte de electrones.
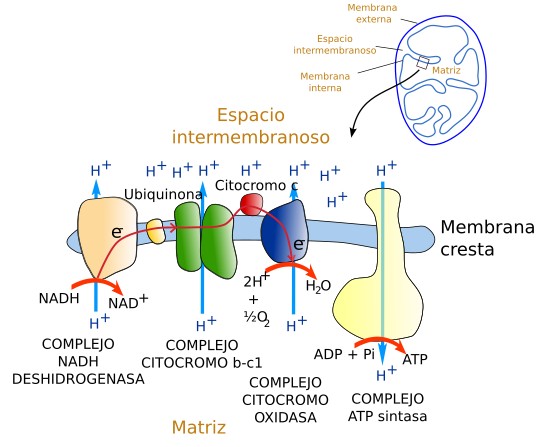
El recorrido de los electrones comienza cuando un ion hidruro es cedido por el NADH. De este ion se desprenden dos electrones y un protón. Esto se produce en el complejo de la NADH deshidrogenasa, el cual acepta los electrones. Tales electrones pasan al complejo b-c1 gracias a la molécula intermedia ubiquinona. El paso de los electrones por el complejo NADH-deshidrogenasa y b-c1 produce la extrusión de dos protones, uno en cada complejo, desde la matriz hasta el espacio interno de la cresta. Los electrones viajan entonces hasta el citocromo C que los transfiere al complejo de la citocromo oxidasa. En este tercer complejo se transporta otro protón al espacio interno de la cresta y los electrones son finalmente aceptados por el oxígeno para producir agua.
El proceso de transferencia de electrones es como en las pilas eléctricas donde los electrones pasan de un material cargado de electrones y con poca afinidad por ellos a otro que tiene una mayor afinidad. Ese salto desprende energía que se utiliza para transportar protones en contra de su gradiente de concentración. Los electrones en el NADH, que están retenidos con poca fuerza, saltan al complejo NADH y así sucesivamente. Si no existiesen los complejos de la cadena respiratoria la energía, en vez de utilizarse para bombear protones, se perdería en forma de calor. El resultado es la creación de un gradiente de protones 10 veces menor en la matriz que en el espacio interno de las crestas mitocondriales. Además, se crea un espacio cargado más negativamente en la matriz como consecuencia de la salida neta de cargas positivas respecto al espacio interno de la cresta, el cual se vuelve más positivo. Se crea así un gradiente electroquímico que hace que los protones tiendan a entrar de nuevo en la matriz.
El enzima ATP sintasa crea una vía hidrofílica en la membrana de la cresta que permite a los protones volver a favor de gradiente electroquímico desde el interior de la cresta hasta la matriz mitocondrial. Este cruce se acopla a la producción de energía en forma de ATP. La ATP sintasa es un enzima altamente conservada durante la evolución y aparece en bacterias, en los cloroplastos de las células fotosintéticas y en todas las mitocondrias. Es una proteína de gran tamaño formada por muchas subunidades. El mecanismo de generación de ATP no está claro pero se sabe que por cada molécula de ATP se deben desplazar 3 protones. Es capaz de producir más de 100 moléculas de ATP por segundo. Un hecho interesante es que la ATP sintasa puede realizar el proceso contrario, es decir, usar ATP para bombear protones al exterior.
La síntesis de ATP no es el único proceso en el cual se usa el gradiente de protones. Otras moléculas cargadas como el piruvato, el ADP y el fósforo inorgánico son bombeadas a la matriz desde el citosol, mientras que otras como el ATP, que se sintetiza en la matriz, deben ser transportadas al citosol. El fósforo inorgánico y el piruvato son transportados acoplándose al flujo hacia el interior de los protones. En cambio el ADP se acopla en cotransporte de tipo antiporte con el ATP.
Metabolismo de lípidos
Una síntesis significativa de los lípidos de las células ocurre en las mitocondrias. Aquí, se produce el ácido lisofosfatídico, a partir del cual se sintetizan triacilgliceroles. También se sintetiza en las mitocondrias el ácido fosfatídico y el fosfatidilglicerol, este último necesario para la producción de cardiolipina y de la fosfatidil etanolamina. La cardiolipina se sintetiza por enzimas asociadas a la superficie de la membrana de las crestas mitocondriales.
Estrés celular
Las células sufren diversos tipos de estrés, como la falta de alimento, el aumento de temperatura, pérdida de la homeostasis proteica, estrés por sustancias oxidativas, etcétera. Para prevenir o revertir los daños provocados por el estrés la célula cuenta con sensores que inician respuestas de protección. Cuando el estrés afecta a las mitocondrias, o incluso es iniciado por fallos en las propias mitocondrias, se inicia una respuesta llamada respuesta a las proteínas no plegadas (UPRMT: “unfolding protein response in mitochondria”). Ésta se inicia cuando se detecta la pérdida de la homeostasis proteica, fallos en el ADN mitocondrial, defectos en la cadena de transporte de electrones, y otros. Entonces se inicia una cascada de señalización en la mitocondria que enlaza con la expresión de genes en el núcleo. Dichos genes son responsables de recuperar la homeostasis mitocondrial. El principal conector entre la mitocondria y el núcleo tras la activación de UPRMT es el factor ATF5, el cual es atrapado en mitocondrias sanas, pero cuando las mitocondrias están alteradas es incorporado al núcleo, donde expresa los genes que ayudan a revertir los daños mitocondriales. También se activan los genes de la glucolisis, y se disminuye la expresión de genes de la cadena de transporte de electrones. Hay otros factores que también participan en esta comunicación mitocondria-núcleo durante la repuesta al estrés.
El estrés mitocondrial puede también ser combatido con la eliminación de mitocondrias mediante autofagia, proceso denominado mitofagia. Las mitocondrias estresadas tienen alterado el mecanismo de importe de proteínas, y algunas de las que deberían ser importadas se acumulan en la membrana externa, donde son modificadas y reconocidas por la vía de autofagia, con lo que la mitocondria es eliminada posteriormente por los lisosomas. La mitofagia disminuye el volumen mitocondrial de la célula. La disminución de oxígeno en la célula produce la activación del factor HIF-1alfa, que a su vez induce la expresión de dos proteínas (NIC y BNIP3) que se localizan en la membrana externa de las mitocondrias como señal para su degradación por autofagia. Sin embargo, hay ejemplos donde se produce mitofagia de forma fisiológica. Durante la diferenciación celular del linaje que da lugar a los eritrocitos hay un incremento de la mitofagia. Así, el paso de reticulocito a eritrocito conlleva la eliminación de todas las mitocondrias gracias a la expresión de moléculas (NIX) en la membrana externa de las mitocondrias que las marca para su degradación. Además, tras la fecundación, las mitocondrias del espermatozoide que se incorporan al citoplasma del óvulo son degradadas de manera selectiva por mitofagia.
El metabolismo normal de la mitocondria genera agentes reactivos de oxígeno (ROS) que actúan como agentes oxidantes y forman parte del llamado estrés oxidativo. Estos ROS se generan en la cadena de transporte de electrones. Se pensaba hasta ahora que estos ROS eran tóxicos para la mitocondria y la célula, pero hoy se sabe que desempeñan papeles en funciones tales como desencadenar la respuesta mitocondrial al estrés, diferenciación y homeostasis.
La cardiolipina y la fosfatidiletanolamina participan en la vía de señalización del estrés mitocondrial. La cardiolipina es un sensor de ROS, ya que se oxida y es entonces degradada. Pero si no se degrada, la cardiolipina oxidada es tóxica para la mitocondria. Además, la cardiolipina oxidada es un mensajero del estrés mitocondrial puesto que se exporta desde la membrana interna a la externa, donde recluta proteínas pro-apoptóticas tales como la procaspasa 8, Bid y BAX, y también interactúa con proteínas que favorecen la mitofagia.
Apoptosis
La mitocondria es un orgánulo capital para iniciar la apoptosis o muerte celular regulada, normalmente consecuencia de un proceso de estrés celular no resuelto. En concreto, es responsable de iniciar la vía apoptótica intrínseca. Cuando la célula está sometida a estrés celular que no se puede contrarrestar se activan las proteínas “BH3-only”, las cuales a su vez activan y oligomerizan a las proteínas BCL2 pro-apoptóticas BAX y BAK. Éstas forman poros en la membrana externa de las mitocondrias por donde sale desde el espacio intermembranoso el citocromo C, además de otras moléculas. El citocromo C permite el ensamblaje del apoptosoma, formado por apaf-1 y la procaspasa 9. El apoptosoma permite el inicio de una cascada de proteolisis que degradará el interior de la célula. La apoptosis se dispara cuando se permeabiliza la membrana, es una vía de no retorno. Empieza en una o unas pocas mitocondrias de la célula y se extiende como una ola por el retos de mitocondrias para generar un efecto inmediato y total. Esta propagación no depende de las caspasas. Las mitocondrias podrían también estar involucradas en otros tipos de muerte celular no apoptótica, tales como la necroptosis, piroptosis y ferroptosis.
Otras
Hay orgánulos derivados de las mitocondrias durante la evolución que han adquirido otras funciones. Por ejemplo, los hidrogenosomas están relacionadas con el metabolismo del hidrógeno y los mitosomas con el del sulfuro. Estos orgánulos carecen de ADN. Por otra parte, recientemente se ha involucrado a las mitocondrias, junto con el retículo endoplasmático, en la generación de los peroxisomas mediante la emisión de vesículas.
5. Renovación de mitocondrias
El conjunto de las mitocondrias de una células está en constante renovación mediante la eliminación y la síntesis de otras nuevas. La síntesis de mitocondrias sólo se puede producir a partir de otra existente y son eliminadas como orgánulos completos por macroautofagia, que es un proceso general de eliminación de grandes cantidades de contenido citoplasmático.
La generación de nuevas mitocondrias está gobernada por varias proteínas. Una de ellas es la denominada PGC-1alfa, la cual actúa sobre muchos genes, entre los que se encuentran NRF1 y NRF2, los cuales favorecen la expresión de genes mitocondriales que se encuentran en el núcleo y otros que están en la propia mitocondria. Esto favorece la proliferación de las mitocondrias.
-
Bibliografía ↷
-
Bock FJ, Tait SWG. 2020. Mitochondria as multifaceted regulators of cell death. Nature reviews. Molecular cell biology. 21:85-100. https://doi.org/10.1038/s41580-019-0173-8
Friedman JR, Nunnari J. 2014. Mitochondrial form and fucntions. Nature. 505: 335-343.
Kiefel BR, Gilson PR, Beech PL. 2006. Cell biology of mitochondrial dynamics. International review of cytology. 254: 151-213.
MacAskill AF, Kittler JT. 2010. Control of mitochondrial transport and localization in neurons. Trends in cell biology. 20: 102-112
Palade GE. 1953. An electron microscope study of the mitochondrial structure. Journal of histochemistry and cytochemistry. 4: 188-211. https://doi.org/10.1177/1.4.188.
Pickles S, Vigi P, Youle RJ. 2018. Mitophagy and quality control mechanisms in mitochondrial maintenance. Current biology. 28:R160-R185
Shen K, Pender L, Bar-Ziv R, Zhang H, Wickham K, Willey E, Durieux J, Ahmad O, Dillin A. 2022. Mitochondria as Cellular and Organismal Signaling Hubs. Annual review of cell and developmental biology. 38: 179-218.
-
 Peroxisomas
Peroxisomas 