Los hepatocitos son las células del hígado y forman aproximadamente el 80 % de la masa de este órgano y el 60 % de sus células. A los hepatocitos se les llama también células parenquimáticas porque forman el parénquima del hígado. Se disponen formando láminas de una célula de espesor que se unen unas con otras formando estructuras tridimensionales a modo de esponja (Figuras 1 y 2). Tienen una vida relativamente larga, puesto que son renovadas aproximadamente cada 5 meses, aunque depende de si hay procesos de regeneración o no. Cuando hay daños en el hígado los hepatocitos tienen una gran capacidad de proliferación y regeneración de la parte dañada.

1. Morfología
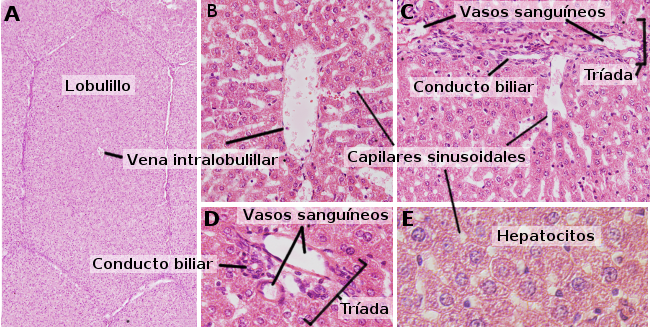
Se suele decir que los hepatocitos son células poliédricas, es decir, que tienen varias caras. Normalmente 6 caras, aunque el número es variable. Las caras pueden estar en contacto con un espacio sinusoidal o con otro hepatocito (Figura 3). Los hepatocitos on células grandes, de unos 20 a 30 µm de diámetro. Poseen núcleos redondeados y centrados en la célula, y en hígados adultos muchos hepatocitos (hasta un 25 % del total) presentan dos núcleos (Figura 2). La mayoría de los núcleos de los hepatocitos son tetraploides, es decir, tienen el doble de contenido de ADN que una célula normal diploide, pero pueden tener 4 y hasta 8 o más copias de cada cromosoma. El tamaño de los núcleos es variable y está relacionado con el grado de ploidía, la cual aumentan con la edad del individuo. Poseen heterocromatina dispersa y uno o más nucléolos bien patentes. Es raro encontrar hepatocitos en mitosis (1 mitosis por cada 10000 0 20000 hepatocitos), pero sí son frecuentes cuando hay algún proceso de regeneración hepática. El aspecto del citoplasma es variable y depende de su estado fisiológico, sobre todo influido por la presencia de almacenes de grasa o glucógeno. El citoplasma del hepatocito posee pequeñas y abundantes mitocondrias, 800 a 1000 por célula. Se ha estimado que una célula hepática puede contener unos 50 complejos de Golgi, que suelen formar pilas de 3 a 5 cisternas con las zonas laterales de las cisternas ensanchadas y con cuerpos densos. Las pilas de cisternas están un tanto esparcidas, localizadas sobre todo en las proximidades de los canalículos biliares (Figuras 3 y 4). Los hepatocitos contienen una gran cantidad de peroxisomas (entre 200 y 300), más que otros tipos celulares. En las proximidades de los canalículos biliares también se pueden observar numerosos lisosomas, pero también en el resto del citoplasma.


Los hepatocitos poseen abundantes depósitos de glucógeno, inclusiones lipídicas (el aspecto granular en las tinciones de hematoxilina y eosina se deben al hueco que dejan dichos depósitos e inclusiones) y cuerpos residuales con lipofucsina. Uno de los orgánulos que destaca por su abundancia es el retículo endoplasmático liso, aunque su cantidad depende del estado metabólico. Donde hay depósitos de glucógeno suele haber abundante retículo endoplasmático liso. Dentro de un lobulillo hepático suele haber diferencias morfológicas entre los hepatocitos periféricos y los centrales debido al riego sanguíneo. Por ejemplo, tras la comida los hepatocitos periféricos son los primeros en almacenar glucógeno y los últimos en movilizarlo por la demanda fisiológica del cuerpo. Mientras que la acumulación de grasa es primero en los células centrales del lobulillo, que también suelen tener más retículo endoplasmático liso (el retículo rugoso tiene un 50 % más de superficie que el liso en las zonas periféricas y medias del lobulillo).
Al contrario que otras células epiteliales, los hepatocitos no están unidos a una lámina basal, sino que sus membranas basolaterales están rodeadas por una matriz extracelular de baja densidad sintetizada por los propios hepatocitos. Esto facilita el intercambio de moléculas con los espacios sinusoidales a través del espacio de Disse, el espacio que hay entre el endotelio fenestrado y los hepatocitos. Esta matriz carece de laminina, al menos cuando el hepatocito está diferenciado. La laminina, junto con el colágeno tipo IV y la fibronectina parecen necesarios para que el hepatocito se diferencie adecuadamente. Los hepatocitos están conectados entre sí por uniones estrechas, y adheridos entre sí por uniones adherentes, desmosomas y uniones en hendidura.
Los hepatocitos son células polarizadas, es decir, hay diferencias celulares entre las partes en contacto con los canales sinusoidales y las que forman parte de los canalículos biliares (Figura 3). Los canalículos biliares son las ramas más delgadas del sistema biliar. Esta polaridad del hepatocito es esencial para muchas funciones hepáticas y su desorganización provoca enfermedades hepáticas. En los hepatocitos se considera apical a la membrana que forma los canalículos biliares. Al igual que en otros epitelios, en la membrana apical hay uniones estrechas, que en este caso sellan y mantienen la integridad de los canalículos biliares. Además, esta membrana apical contiene microvellosidades que aumentan la superficie, representa hasta un 13 % del total del membrana del hepatocito, que permite acomodar más moléculas de membrana. La eliminación de las uniones estrechas provoca la pérdida de la polaridad. La polaridad de los hepatocitos y la formación de los canalículos biliares se establecen durante el desarrollo embrionario.
La polaridad funcional depende del desigual reparto de transportadores y moléculas entre las membranas apicales y las basolaterales. Entre las más importantes están los transportadores de membrana de tipo ABC ("ATP binding casettes") que son dirigidos al dominio apical. Este reparto diferencial depende a su vez del aparato de Golgi, los endosomas y el citoesqueleto (microtúbulos y filamentos de actina). Esto se hace mediante dos rutas principales (Figura 5). a) los transportadores ABC se liberan desde el aparato de Golgi en vesículas y son transportados directamente a la membrana apical o a los endosomas de reciclado, que actúan como intermediarios. b) Otras proteínas lo hacen mediante transcitosis, viajando primero a las membranas basolaterales y desde ahí a endosomas que envían vesículas a la membrana apical. Incluso hay una vía peculiar para los transportadores de cobre, los cuales llegan mediante exocitosis de lisosomas.

2. Funciones
La principal función de los hepatocitos es metabolizar sustancias procedentes de la digestión. Esto es posible porque el hígado se encuentra irrigado por la venas porta, que recogen las moléculas resultantes de la digestión del intestino. Aparte de terminar de degradar sustancias digeridas, también tienen un papel importante en la detoxificación de moléculas potencialmente dañinas para el organismo. Por otra parte, los hepatocitos sintetizan y secretan la bilis, la cual será liberada en el tubo digestivo para ayudar en la digestión. Para ello se encuentran en un lugar privilegiado, formando una capa entre los canales sinusoidales (que traen las sustancias del digestivo) y los canalículos biliares (que transportan la bilis).
Niveles de glucosa. Los hepatocitos captan la glucosa de la digestión y la almacenan en forma de glucógeno, que será movilizado cuando el organismo necesite energía. El glucógeno se localiza normalmente próximo al retículo endoplasmático puesto que es en este orgánulo donde se encuentra la enzima glucosa-6-fosfatasa, encargada de convertir glucosa-6-fosfato, resultante de la degradación del glucógeno, en glucosa libre que puede salir de la célula y pasar al torrente sanguíneo.
Síntesis de moléculas. Uno de las sustancias sintetizadas por los hepatocitos son las sales biliares, las cuales serán necesarias para la digestión de las grasas. En el retículo endoplasmático liso se encuentran numerosas enzimas relacionadas con la síntesis del colesterol y otros lípidos. Pero además, los hepatocitos sintetizan las lipoproteínas necesarias para transportar lípidos por la sangre. También sintetizan fibrinógeno para la coagulación de la sangre cuando hay heridas, así como albúminas plasmáticas. Como metabolito resultante del metabolismo de la degradación de las proteínas producen urea, que si se acumula en el organismo puede ser peligrosa. También almacenan vitaminas A y B, y heparina.
Metabolismo lipídico. En los numerosos peroxisomas que poseen los hepatocitos se produce la beta-oxidación.
Detoxificación. Los hepatocitos reciben directamente las sustancias nutritivas de la digestión, pero también son los primeros en recibir sustancias potencialmente tóxicas. El etanol consumido en las bebidas alcohólicas es degradado principalmente en el hígado, más concretamente en los abundantes peroxisomas que estas células poseen. Aproximadamente la mitad del alcohol ingerido es convertido en acetaldehído en los peroxisomas de los hepatocitos. En el retículo endoplasmático liso se encuentran enzimas que participan en la eliminación de toxinas y fármacos. Cuando hay que eliminar muchas de estas sustancias al mismo tiempo, por ejemplo, durante un tratamiento farmacológico o por consumo continuado de alcohol, el retículo puede convertirse en el orgánulo más voluminoso de la célula. La eliminación de fármacos es normalmente por conjugación de éstos con otras moléculas. Por ejemplo, la glucuroniltransferesa se puede conjugar con los barbitúricos.
Almacén y regulación del hierro. Los hepatocitos funcionan como almacenes de hierro, el cual se acumula en depósitos en el citosol unido a ferritina. Pueden captar hierro en diversas formas: unido a transferrina, no unido a transferrina, en grupos hemo y en grupos no hemo. El unido a transferrina lo hace mediante endocitosis mediada por el receptor TRF1. La acidificación de los endosomas provoca que la transferrina libere el hierro Fe3+, que se convierte en Fe2+ y es sacado al citosol por DMT1 (transportador de metales divalentes). El hierro de los grupos hemo también se incorpora por endocitosis y el grupo hemo-hierro atraviesa la membrana de los endosomas por el transportador HRG1. Sin embargo, la mayor parte del hierro se incorpora directamente desde el plasma por el transportador ZIP14 localizado en la membrana de los hepatocitos que dan hacia los sinusoides. Una vez en el citosol, el hierro se almacena en depósitos citosólicos unido a ferritina, puesto que el ión libre es tóxico. La liberación de hierro desde el medio interno hacia el exterior del hepatocito es mediante el transportador ferroportina localizado en la membrana sinusoidal.
El hígado es el segundo mayor centro de producción de grupos hemo del cuerpo, tras la médula ósea. El grupo hemo es un grupo prostético (no peptídico) en varias proteínas que transportan oxígeno, en aquellas proteínas que protegen frente a agentes oxidantes como la catalasa y peroxidasa, está también presente en los citocromos mitocondriales y en los citocromos peroxisomales. La máxima cantidad de grupos hemo está en la hemoglobina cuyo grupo hemo se sintetiza en el médula ósea. En el hígado la síntesis depende de la demanda del citocromo microsomal p450, así la mayor parte de grupos hemo forma parte de este citocromo.
Además de la función de almacén, los hepatocitos tienen una función hormonal. Liberan una hormona denominada hepcidina, la cual regula la concentración sistémica de hierro. Esta hormona controla el flujo de hierro en el plasma mediante su unión a la ferroportina, que se encuentra en enterocitos, macrófagos y hepatocitos, provocando su internalización y degradación, y por tanto se inhibe la liberación de hierro desde estas células. La producción de esta hormona se estimula por la hierro-transferrina del plasma, por los depósitos de hierro del hígado y por inflamación. La actividad eritropoyética inhibe la liberación de hepcidina.
Heterogeneidad funcional
Algo interesante es que, aunque morfológicamente sean similares, hay una regionalización funcional de los hepatocitos en el lobulillo hepático y que todas las funciones mencionadas anteriormente son llevadas a cabo de manera diferente por los hepatocitos según se encuentren en la periferia, próximos a la zona portal, hacia el interior del lobulillo hepático, o en una región intermedia entre ambas. Los lóbulos hepáticos son estructuras más o menos hexagonales en secciones que miden unos 0,5 mm de diámetro en ratones y aproximadamente 1 mm en humanos. Los vértices se llaman nodos portales. Desde las zonas portales hasta el centro de cada lobulillo hepático hay un gradiente de sustancias: más oxígeno y sustancias digestivas en la periferia que en la zona central, y más metabolitos liberados por los hepatocitos en la zona central que en la portal. Se establece una zonación en el lobulillo hepático con diferente funcionamiento de los hepatocitos según su posición.
Esto tienen su reflejo en la expresión diferencial de cientos de genes entre hepatocitos portales y periportales. Aproximadamente la mitad de los genes que expresan los hepatocitos tienen carácter zonal en ratón, 3500 de 7000. Es más bien un gradiente de expresión, es decir, no es sí o no.
En los periportales, en la periferia, hay más acumulación de glucógeno, menos de grasa, mitocondrias más grandes, más acumulación de gránulos biliares y más abundancia de glucosa-6 fosfatasa, entre otros. Las funciones con una alta demanda de energía se llevan a cabo sobre todo por los hepatocitos periportales (secreción de albúmina, proteínas del complemento y coaguladores sanguíneos). Esto es consecuencia de la mayor concentración de oxígeno y de nutrientes. Así, los periportales estarían más implicados en la glucogenogénesis y los centrales en glucogenolisis. También habría zonación metabólica para el metabolismo oxidativo, formación de urea, degradación de ácidos grasos, lipogénesis y detoxificación de alcohol. Los hepatocitos de la zona intermedia, además de ser una zona de transición, tienen también sus características. Por ejemplo, es la zona donde se libera la hormona hepcidina que regula los niveles sistémicos de hierro. En todo este sistema se supone que los hepatocitos son similares y que sólo cambian su comportamiento metabólico en función de la concentración de los estímulos que reciben según su posición (oxígeno, metabolitos, hormonas, etc). Sin embargo, podría haber modificaciones epigenéticas que actúen a largo plazo.
También hay procesos metabólicos en cadena que se desarrollan secuencialmente en diferentes zonas, como es la producción de la bilis, donde hay enzimas en la zona periférica y otras en la media. De la misma manera, el consumo y la producción de sustancias crea un gradiente desde la periferia hasta el centro. Los transportadores de poca afinidad se encuentran en la periferia y los de alta afinidad en la zona central. Desde las células endoteliales que están próximas a la vena central se liberan moléculas Wnt que por gradiente de concentración van influyendo en el metabolismo de los hepatocitos desde el interior hasta la periferia.
3. Renovación hepática
Los hepatocitos tienen una gran capacidad de proliferación. Esto ocurre de manera normal, para mantener la homeostasis del hígado, y tras procesos patológicos. Incluso, cuando la proliferación de los hepatocitos se inhibe, nuevos hepatocitos pueden surgir de los colangiocitos, que son las células epiteliales que forman los conductos biliares. No se sabe aún con certeza si existe una población de células madre adultas de hepatocitos en el hígado, o en los conductos biliares, o si los hepatocitos maduros son capaces de desdiferenciarse para proliferar.
-
Bibliografía ↷
-
Ben-Moshe S, Itzkovitz S. 2019. Spatial heterogeneity in the mammalian liver. Nature reviews in gastroenterology and hepatology. 16:395-410.
Gissen P, Arias IM. 2015. Structural and functional hepatocyte polarity and liver disease. Journal of hepatholoty. 63: 1023-1037.
Knutson MD. 2014. Adult intestinal stem cells: critical drivers of epithelial homeostasis and regeneration. Nature review in molecular cell biology. 15:19-33.
Weiss L, Greep RO. 1982. Histología. 4ªedición. Editorial el Ateneo. Barcelona.
-