Éste un resumen del trabajo fin de grado de Clara Leboreiro Babé, defendido en 2017 en la Universidad de Vigo.
Numerosas enfermedades son detectadas y evaluadas mediante técnicas inmunohistoquímicas. La calidad de los resultados de estas pruebas es a menudo esencial para tomar una decisión sobre el tratamiento o el estadio en el que se encuentra dicha enfermedad. Una de las precauciones a la hora de emplear técnicas inmunohistoquímicas es tener en cuenta la posible alteración de los antígenos debido a la fijación y procesamiento de los tejidos.
En la mayoría de los laboratorios de patología clínica se procesan los tejidos mediante la fijación en formol y posterior inclusión de los mismos en parafina. Este fijador es una disolución acuosa de formaldehído, normalmente a una concentración del 4%. Se ha demostrado que el formaldehído provoca numerosas y complejas reacciones entre las proteínas del tejido, principalmente enlaces cruzados entre dichas proteínas (Figura 1). La fijación excesiva en paraformaldehído daña muchos antígenos. El fijador crea enlaces entre proteínas que cambian la organización tridimensional por lo que puede ocurrir que los epitopos, zonas de unión del anticuerpo, queden ocultos o enmascarados. Normalmente se considera que un tejido está sobrefijado cuando se mantiene en fijador más de 24 horas. En soluciones acuosas el formaldehído forma metileno hidratado que reacciona con una gran cantidad de cadenas laterales de las proteínas para formar grupos reactivos hidroximetilo, los cuales se unen a otras proteínas presentes en el tejido formando puentes de metileno. Las cadenas laterales de las proteínas que presentan mayor reactividad con este compuesto contienen los aminoácidos cisteína, lisina, histidina y tirosina.
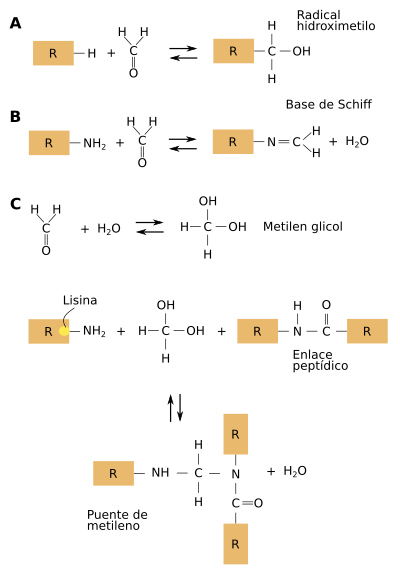
Las proteínas entre las que se producen los enlaces cruzados incluyen algunas que actúan como antígenos y que se emplean en la detección de numerosas patologías mediante técnicas inmnunohistoquímicas. Estos enlaces impiden en ocasiones que el anticuerpo pueda reconocer a la proteína porque los sitios de unión o epitopos quedan enmascarados. Como consecuencia se pueden generar falsos negativos en los resultados, es decir, se dan casos en los que el antígeno se encuentra en el tejido y debido a este enmascaramiento antigénico no se detecta inmunohistoquímicamente.
Además de las modificaciones descritas, la formación de complejos de calcio, la modificación de la conformación de las proteínas y la variación de la carga electrostática de las mismas se consideran fenómenos causantes de enmascaramiento de antígenos por efecto del formol. Se cree que las modificaciones proteicas se producen en la cadena aminoacídica, o estructura primaria de la proteína, siendo menos relevante las alteraciones en las estructuras secundarias y terciarias, aunque en ocasiones también se pueden modificar estas últimas alterándose de este modo los epitopos conformacionales. La unión antígeno-anticuerpo depende sobre todo de fuerzas electrostáticas y la fijación con formaldehído modifica también la carga electroestática superficial del antígeno completo y del epitopo específico a detectar, impidiendo la interacción antígeno-anticuerpo.
Los enlaces cruzados formados por el formaldehído son estables a ciertos niveles de pH, temperatura y según el medio en el que se encuentre el tejido. Sin embargo, tienen la particularidad de ser reversibles y si estos factores son modificados se podrían romper dichos enlaces y los epitopos de interés quedarían expuestos. El proceso por el que se consigue desenmascarar los epitopos para ser reconocidos por anticuerpos se conoce como recuperación de antígenos o recuperación antigénica. La recuperación de antígenos se podría llevar a cabo mediante la eliminación de barreras moleculares que impiden el reconocimiento del antígeno por parte del anticuerpo; de este modo la técnica de recuperación antigénica revertiría la mayoría de las modificaciones generadas por la fijación, restableciéndose una conformación proteica casi idéntica a la original, restaurando la carga electrostática de las proteínas y recuperando su inmunoreactividad previa a la fijación con formol.
La recuperación antigénica ha mejorado la técnica inmunohistoquímica para su uso en el diagnóstico de patologías. Se definen dos etapas en la historia del empleo de la inmunohistoquímica en histología, pre-antigen-epitope retrieval y post-antigen-epitope retrieval, debido a la importancia que supuso su introducción en los laboratorios. El formol es el fijador más común en la mayoría de los laboratorios de anatomía patológica, así como en los bancos de tejidos, y en ambos casos es habitual realizar el proceso de desenmascaramiento antigénico antes de emplear inmunohistoquímica en los tejidos. Una ventaja adicional que conlleva el uso de esta técnica es que consigue un menor umbral de detección del antígeno, permitiendo emplear diluciones mayores de anticuerpo; esto, además de suponer una ventaja económica, reduce el ruido de fondo y se aumenta la señal del marcaje. Los tejidos que se encuentran en los denominados bancos de tejidos han adquirido un enorme valor gracias al uso de esta técnica, ya que se posibilita que tejidos fijados décadas atrás y en diferentes laboratorios se empleen para investigaciones clínicas. Además, es posible la combinación de la técnica de recuperación de antígenos junto con la proteómica para la búsqueda y uso de biomarcadores en medicina personalizada.
Debido a que la formación de puentes cruzados por el formol depende en gran medida de la estructura primaria de las proteínas, la recuperación antigénica va a estar determinada por la secuencia de aminoácidos de cada antígeno. Se ha demostrado que determinados antígenos necesitan de unas condiciones específicas para su recuperación. Algunos antígenos precisan ser recuperados para poder detectarse en una tinción inmunohistoquímica, mientras que para otros antígenos la técnica de recuperación antigénica no es esencial para su detección pero su aplicación aumenta la señal de marcaje. En algunos casos la recuperación antigénica ha dado lugar a falsos positivos, pero también a falsos negativos, por lo que el correcto ajuste de las condiciones de recuperación es de vital importancia. Esto significa que una aproximación incorrecta a la técnica de recuperación de antígenos puede no mejorar la señal de marcaje, e incluso disminuir la misma. Por tanto, es recomendable elaborar un protocolo de recuperación de antígenos particular para el antígeno en el que se esté interesado.
1. Métodos de recuperación
El origen de la técnica de recuperación de antígenos consistió en hervir secciones de tejido en agua. Posteriormente se comenzaron a emplear tampones en sustitución del agua con el fin de mantener la conformación de las proteínas. A día de hoy, hay una gran diversidad en cuanto a métodos de recuperación antigénica que combinan el uso de diversas fuentes de calor, tampones y actividad enzimática. El desenmascaramiento por calor es el método más usado. La actividad enzimática se emplea como un método alternativo cuando hay que desenmascarar antígenos que puedan perder antigenicidad si son expuestos al calor, como las citoqueratinas. Las proteasas más usadas son tripsina, proteinasa K, pepsina, pronasa, ficina, y otras.
Los métodos de recuperación de antígenos se dividen según se aplique calor, en cuyo caso se emplean las siglas HIER (Heat-Induced Epitope Retrieval), o si se basa en el uso de enzimas proteolíticas, conocido como PIER (Proteolytic-Induced Epitope Retrieval).
Método por calor
El método HIER es el más común, con variaciones en cuanto a las fuentes de calor utilizadas. HIER ha revolucionado la inmunocitoquímica en los laboratorios de patología porque ha permitido detectar un número asombroso de antígenos que antes no se podían estudiar. Teóricamente el calor rompe los enlaces credos por el formaldehído, aunque todavía no está claro cómo funciona. La mayoría de los investigadores utilizan el microondas o un recuperador de antígenos de funcionamiento similar a un autoclave. Como alternativa, se puede emplear un baño caliente o una estufa. Cada fuente de calor presenta una serie de ventajas y desventajas (Tabla 1). Es curiosos que las fijaciones por alcohol, que en teoría no van a formar enlaces, también parecen beneficiarse por el desenmascaramiento por calor.
Tabla 1. Resumen de las características más importantes de las fuentes de calor comúnmente empleadas
en el método HIER:
| Baño caliente | Microondas | Olla a presión | |
| Rango de temperatura | 25 a 100 ºC | 85 a 95 ºC | 25 a 125 ºC |
| Regulación de la temperatura | Buena | Buena | Óptima |
| Evaporación potencial de la solución tampón | Significativa | Significativa | Mínima |
| Desbordamiento potencial por ebullición | Nulo | Significativo | Nulo |
El aparato más usado para desenmascarar antígenos por calor son los autoclaves o las ollas a presión. En estos aparatos se pueden conseguir temperaturas mayores a los 100 grados sin que ebulla el líquido, y así el tiempo de calentamiento es más corto. Un tiempo de unos 8 a 10 minutos a máxima temperatura (110-120 ºC) suele ser óptima. Variaciones de 1 a 2 minutos, así como el tiempo de enfriamiento, pueden afectar a los resultados. Hay que tener en cuenta que el uso de ollas a presión parece aumentar la reactividad de la biotina endógena. Esto puede dar lugar a falsos positivos. Por ejemplo, la piruvato carboxilasa de las mitocondrias tiene 4 moléculas de biotina, luego artefactos se pueden dar en células metabólicamente activas. Por eso es importante siempre hacer un control negativo quitando el primer anticuerpo. Parece que las soluciones urea potencian estos artefactos, mientras que son menos evidentes con el tampón Tris.
El microondas es otro aparato que se emplea para producir calor puesto que es rápido y el calor se produce incluso dentro del tejido, útil para muestras grandes. El problema del uso de los microondas es que cada aparato tiene su "personalidad" y estandarizar resultados debe hacerse en cada laboratorio de forma individual. Otro aspecto a tener en cuenta es que la cantidad de volumen introducido afecta a la velocidad de calentamiento por lo que es bueno colocar siempre el mismo volumen, independientemente del número de muestras. Los microondas tienen la desventaja de que puede producirse un calentamiento irregular y que una base giratoria es imprescindible. Además, hay que realizar un control visual para evitar ebulliciones violentas del líquido, lo que lleva a que tengamos que rellenar los medios de incubación, con el consiguiente alteración del mantenimiento de la temperatura.
Los principales factores que afectan a la recuperación de antígenos en el método HIER son la temperatura y el pH de la solución tampón en la cual se sumerge el tejido durante el proceso de recuperación antigénica. El efecto de la temperatura depende de dos variables, la temperatura alcanzada y el tiempo de exposición al calor. A medida que aumenta la temperatura alcanzada se debe disminuir el tiempo de exposición, y viceversa. Por otra parte, la composición del tampón no parece tener tanta importancia como su pH. Así, determinados antígenos se recuperan con mayor facilidad a pH básicos mientras que otros precisan de pH ácidos. El tampón que se suele usar en pH ácidos es el tampón citrato, mientras que a pH básicos es más común el tampón Tris. Ejemplos de soluciones empleadas son: tampón citrato pH 6, EDTA 0.1 M pH 8, Tris 0,5 M pH 10, tampón clorhídrico-glicina 0.05 M, 01 % de ácido peryódico, varias concentraciones de urea, soluciones de tiocianato de plomo, etcétera.
Se ha estudiado el efecto que podría tener el calcio en la recuperación antigénica ya que su presencia en los tejidos parece promover el enmascaramiento antigénico, mediante la formación de complejos moleculares en los que participa el calcio endógeno durante el procesamiento del tejido. Para tratar de solucionar este problema son numerosos los estudios que emplean EDTA como componente de los tampones en la recuperación antigénica. El EDTA es un compuesto que se emplea como quelante de calcio con el fin de eliminar el calcio presente en el tejido. Sin embargo, hay controversia respecto al papel que podría tener este elemento pues algunos resultados sugieren que el EDTA no afecta a la recuperación antigénica de determinados antígenos.
En algunos casos es necesario realizar inmunocitoquímica en muestras o biopsias evitando la realización de cortes, de manera que se puede tener una información tridimensional en el tejido de nuestro marcador. En estos casos es un problema someter a la muestra a temperaturas elevadas puesto que los tejidos se deterioran enormemente y la muestra se encoge, arruga o directamente se destroza. En este tipo de muestras quizá los tejidos más difíciles de estudiar con inmunocitoquímica son los epitelios muy densos y órganos muy pigmentados. Para órganos intactos o porciones de ellos se han propuesto reactivos basados en SDS (dodecil sulfato sódico) para la recuperación de antígenos. Como hay antígenos sensibles a SDS, alternativamente se puede usar el detergente Zwittergent® 3-10 más urea. Este último es bueno para todos los tipos de tejidos, incluso los de más alta densidad celular. En ambos casos se emplea una temperatura de unos 54 ºC durante menos de 28 horas. Este tratamiento mantiene la estructura 3D del tejido. La secuencia en laboratorio consiste en la obtención de la muestra, permeabilización, recuperación del epitopo, tinción, aclaramiento del tejido. Esto último es también necesario para poder observar las señales más profundas en el tejido.
Método por enzimas
En el método PIER las enzimas más comunes son la proteinasa K y la tripsina, las cuales degradan los puentes metileno. La duración de la aplicación enzimática debe ajustarse en función del tiempo de fijación al que ha estado sometido el tejido. Debido a que un tiempo inadecuado de exposición a la actividad enzimática puede dañar el tejido no es un método empleado en muchos laboratorios. Se ha sugerido la utilización combinada de ambos métodos, PIER y HIER, en aquellos casos en los que no se obtienen buenos resultados empleando uno de estos dos métodos por separado.
2. Evaluación
La evaluación de una tinción inmunohistoquímica mediante métodos cuantitativos no está muy extendida a día de hoy, pues todavía se siguen evaluando las tinciones por observación directa al microscopio, es decir, cualitativamente. El análisis de imagen permite una evaluación cuantitativa de una imagen digital. Depende de dos factores: los equipos para la adquisición de imágenes digitales y los programas de análisis de imagen. A continuación se describen los aspectos a tener en cuenta:
Adquisición de imágenes. Éstas pueden ser tomadas en escala de grises o en formato RGB. Se deben tener en cuenta los efectos que compensan las cámaras digitales como la compensación de color, iluminación, balance de blancos y óptica del microscopio. Por tanto, las condiciones de captura de imágenes han de ser exactamente iguales para todas las muestras.
Tipo de sensor de la cámara. Existen dos tipos de sensores, los CCD (Charge Coupled Device) y los CMOS (Complementary Metal Oxide Semiconductor). La tecnología de los CCD es más avanzada, se considera superior y más adecuada para el análisis científico de imagen ya que los píxeles son más grandes. Además, los equipos con tecnología CMOS normalmente generan imágenes con más ruido, especialmente cuando se trabaja con fluorescencia. Formato de imagen. Determinados formatos de imagen comprimen las fotografías perdiendo calidad y, por lo tanto, información. La calidad de la imagen depende también de su resolución. Por tanto, hay que encontrar el balance entre el grado de compresión y el tamaño de la imagen.
Análisis de imagen. Para analizar una imagen digital tomada de un tejido procesado inmunohistoquímicamente se presupone que hay una relación directa entre la señal y la cantidad de antígeno, y que por lo tanto una mayor intensidad de tinción corresponde con una mayor concentración antigénica. A pesar de que el análisis de imagen reduce el error a la hora de evaluar una tinción inmunohistoquímica, es necesario que las muestras a comparar sigan exactamente el mismo protocolo antes de tomar la imagen digital: recolección, fijación, inclusión, tratamiento de recuperación de antígenos, e inmunotinción. De otra manera se pueden obtener resultados erróneos.
-
Bibliografía ↷
-
Alelú-Paz, R., Haroutunian, V., Iturrieta-Zuazo, I., Byne, W., García-Villanueva, M., Rábano, A., García-Amado, M., Prensa, L., Giménez-Amaya, J.M. (2008). A new antigen retrieval technique for human brain tissue. PLOS ONE. 3: e3378.
Balgley, B.M., Guo, T., Zhao, K., Fang, X., Tavassoli, F.A., Lee, C.S. (2009). Evaluation of archival time on shotgun proteomics of formalin-fixed paraffin-embedded tissues. J. Proteome. Res. 8: 917-925.
Battifora, H. (1991). Assessment of antigen damage in immunohistochemistry. The vimentin internal control. Am. J. Clin. Pathol. 96: 669-671.
Boenisch, T. (2006). Heat-induced antigen retrieval: what are we retrieving? J. Histochem. Cytochem. 54: 961-964.
Bogen, S., Vani, K., Sompuram, S. (2009). Molecular mechanisms of antigen retrieval: antigen retrieval reverses steric interference caused by formalin-induced crosslinks. Biotech. Histochem. 84: 207-215.
D’Amico, F., Skarmoutsou, E., Stivala, F. (2009). State of the art in antigen retrieval for immunohistochemistry. J. Immunol. Methods. 341: 1-18.
Elias, J.M., Rosenberg, B., Margiotta, M., Kutcher, C. (1999). Antigen restoration of MIB-1 immunoreactivity in breast cancer: combined use of enzyme predigestion low temperature for improved measurement of proliferation indexes. J. Histotechnology. 22: 103-106.
Eltoum, I., Fredenburgh, J., Myers, R.B., Grizzle, W.E. (2001). Introduction to the theory practice of fixation of tissues. J. Histotechnology. 24: 173-190.
Ezaki, T. (2000). Antigen retrieval on formaldehyde-fixed paraffin sections: its potential drawbacks optimization for double immunostaining. Micron. 31: 639-649.
Floyd, A.D. (2010) Image analysis in inmunohistochemistry. En: Shi, S-R., Taylor, C.R. Antigen retrieval inmmunohistochemistry based research diagnostics. New Jersey: John Wiley & Sons Inc, pp. 165-185.
Fowler, C.B., Evers, D.L., O’Leary, T.J., Mason, J.T. (2011). Antigen retrieval causes protein unfolding. J. Histochem. Cytochem. 59: 366-381.
Fox, C.H., Johnson, F.B., Whiting, J., Roller, P.P. (1985). Formaldehyde fixation. J. Histochem. Cytochem. 33: 845-853.
Fraenkel-Conrat, H., Cooper, M., Olcott, H.S. (1945). The reaction of formaldehyde with proteins. J. Am. Chem. Soc. 67: 950-954.
Frost, A.R., Sparks, D., Grizzle, W.E. (2000). Methods of antigen recovery vary in their usefulness in unmasking specific antigens in immunohistochemistry. Appl. Immunohistochem. Mol. Morphol. 8: 236-243.
Gown, A.M., Willingham, M.C. (2002). Improved detection of apoptotic cells in archival paraffin sections: immunohistochemistry using antibodies to cleaved caspase 3. J. Histochem. Cytochem. 50: 449-454.
Gown, A.M. (2004). Unmasking the mysteries of antigen or epitope retrieval formalin fixation. Am. J. Clin. Pathol. 121: 172-174.
Kahveci, Z., Minbay, F., Noyan, S., Çavusoglu, I. (2003). A comparison of microwave heating proteolytic pretreatment antigen retrieval techniques in formalin fixed, paraffin embedded tissues. Biotech. Histochem. 78: 119-128.
Long, D.J., Buggs, C. (2008). Microwave oven-based technique for immunofluorescent staining of paraffin-embedded tissues. J. Mol. Histol. 39: 1-4.
Messal HA, Almagro J, Zaw Thin M, Tedeschi A, Ciccarelli A, Blackie L, Anderson KI, Miguel-Aliaga I, van Rheenen J, Behrens A. (2021). Antigen retrieval and clearing for whole-organ immunofluorescence by FLASH. Nature Protocoles. 16(1):239-262. doi: 10.1038/s41596-020-00414-z. .
Namimatsu, S., Ghazizadeh, M., Sugisaki, Y. (2005). Reversing the effects of formalin fixation with citraconic anhydride heat: a universal antigen retrieval method. J. Histochem. Cytochem. 53: 3-11.
Rait, V.K., O’Leary, T.J., Mason, J.T. (2004). Modeling formalin fixation antigen retrieval with bovine pancreatic ribonuclease A: I-Structural functional alterations. Lab. Invest. 84: 292-299.
Ramos-Vara, J.A., Beissenherz, M.E. (2000). Optimization of immunohistochemical methods using two different antigen retrieval methods on formalin-fixed paraffin-embedded tissues: experience with 63 markers. J. Vet. Diagn. Invest. 12: 307-311.
Shi, S.R., Cote, R.J., Taylor, C.R. (1997). Antigen retrieval immunohistochemistry: past, present, future. J. Histochem. Cytochem. 45: 327-343.
Shi, S.R., Cote, R.J., Taylor, C.R. (2001). Antigen retrieval techniques: current perspectives. J. Histochem. Cytochem. 49: 931-937.
Shi, S.R., Cote, R.J., Yang, C., Chen, C., Xu, H.J., Benedict, W.F., Taylor, C.R. (1996). Development of an optimal protocol for antigen retrieval: a “test battery” approach exemplified with reference to the staining of retinoblastoma protein (pRB) in formalin-fixed paraffin sections. J. Pathol. 179: 347-352.
Shi, S.R., Imam, S.A., Young, L., Cote, R.J., Taylor, C.R. (1995). Antigen retrieval immunohistochemistry under the influence of pH using monoclonal antibodies. J. Histochem. Cytochem. 43: 193-201.
Shi, S.R., Key, M.E., Kalra, K.L. (1991). Antigen retrieval in formalin-fixed, paraffin-embedded tissues: an enhancement method for immunohistochemical staining based on microwave oven heating of tissue sections. J. Histochem. Cytochem. 39: 741-748.
Shi, S.R., Shi, Y., Taylor, C.R. (2011). Antigen retrieval immunohistochemistry: review future prospects in research diagnosis over two decades. J. Histochem. Cytochem. 59: 13-32.
Taylor, C.R., Shi, S.R., Chen, C., Young, L., Yang, C., Cote, R.J. (1996). Comparative study of antigen retrieval heating methods: microwave, microwave pressure cooker, autoclave, steamer. Biotech. Histochem. 71: 263-270.
Yamashita S., Okada Y. (2005) Mechanisms of heat-induced antigen retrieval: analyses in vitro employing SDS-PAGE immunohistochemistry. J. Histochem. Cytochem. 53: 12-21.
-