En esta página se explica cómo se ha llegado al modelo químico y físico de membrana celular con el que hoy se trabaja y se explica en los libros de texto. Actualmente la descripción de las células no se entiende sin las membranas. Las membranas no sólo establecen límites de la célula y los compartimentos intracelulares sino que multitud de funciones de las células residen en las membranas. Sin embargo, la formulación de la teoría celular se hizo sin conocimiento de la existencia de las membranas y sólo fue considerada necesaria en el siglo XX. De hecho, el concepto de membrana no fue muy popular hasta principios del siglo XX.
Inicialmente se llamó membrana a las paredes celulares más la porción citoplasmática adherida a ellas, que se obervaba con dificultad con los microscopios de los siglos XVII y XVIII. Un paso importante para eliminar esa ambigüedad fue la posibilidad de que las células vegetales podían separarse de su “membrana” o pared celular. Por tanto la célula no dependía de la pared celular. Esto fue un avance importante también para poner en el mismo plano a las células animales y vegetales.
La estructura de la membrana celular, es decir, cómo se organizan las moléculas que la componen, ha ido en paralelo con el descubrimiento de dichas moléculas y sus propiedades, así como con el avance de los aparatos como el microscopio electrónico y de las técnicas experimentales en los laboratorios (Figura 1). Inicialmente se pensaba que las células estaban delimitadas por una capa terminal de características desconocidas, que se describía como un límite del protoplasma.

La primera propuesta sobre la composición de la membrana fue hecha por C.E. Overton en 1895 (Figura 2). Propuso que el trasiego de moléculas entre la célula y su entorno no dependía de la pared celular. Observó que las moléculas de naturaleza lipídica entraban más fácilmente en las células que las hidrofílicas por lo que intuyó que debía existir una barrera o cubierta lipídica delimitando a la célula. Incluso llegó a proponer que estaba compuesta por colesterol y otros lípidos. C.E. Overton no fue el primero en sugerir que había un límite lipídico en la célula, ya se había mencionado hacia 1880, pero sus trabajos fueron más contundentes.
Más tarde, I. Langmuir descubrió que los lípidos anfipáticos, con una parte hidrófoba y otra hidrofílica, se disponían en las superficies acuosas formando monocapas con las cabezas polares hacia la parte acuosa y la parte hidrófoba fuera del agua. Es decir, formaban una membrana de una capa de lípidos (Figura 2). Esta idea fue importante para interpretaciones posteriores de la membrana celular puesto que la célula poseía estos lípidos anfipáticos en forma de glicerofoslípidos y esfingolípidos. Otras líneas de investigación como la electrofisiología habían llegado a la conclusión de los axones de las células poseían electrolitos y podían crear gradientes gracias a envueltas semipermeables que podían cruzarse de manera regulada.
En torno a 1925, E. Gorter y F. Grendel, querían saber cuántos lípidos había en los eritrocitos. Se encontró que los lípidos extraídos de la membrana de los glóbulos rojos, los cuales sólo tienen la membrana plasmática, formaban una monocapa en la superficie de soluciones acuosas con un área que era el doble de la superficie estimada de la membrana del propio glóbulo rojo (Figura 2). Parece ser que se cometieron muchos errores cuantitativos en estos experimentos, pero, por suerte, unos compensaron a otros. Ellos encontraron una relación superficie eritrocito: superficie de lípidos extendidos de 1:2. En realidad, estudios más tardíos y precisos dan una relación de 1:1,3. Ese 0,7 que falta es debido a las proteínas, que por aquel entonces no sabía que debían incorporarse en las membranas.
De cualquier manera, el resultado que ellos obtuvieron les llevó a proponer que los glicerofosfolípidos se organizaban formando una bicapa lipídica con las cabezas polares hacia la solución acuosa, intracelular y extracelular, respectivamente, mientras que sus partes hidrófobas quedaban recluidas en su interior, a salvo del ambiente acuoso. Habían propuesto el modelo de bicapa lipídica de la membrana celular que explicaba tanto sus características físicas como químicas, y que además era termodinámicamente favorecida (Figura 2). Esta disposición se ajustaba más o menos al grosor de la membrana de 4 nm, estimado por H. Fricke en 1920-1930 tras medir la capacitancia de la membrana. Este modelo de bicapa lipídica fue la base para futuros ajustes y reformulaciones de organización de la membrana celular.
En la década de 1930 nuevos experimentos aportaron datos acerca de las propiedades mecánicas de las membranas, los cuales no podían ser explicados simplemente con la participación de los lípidos. Éstos incluían tensión superficial, permeabilidad de solutos y resistencia eléctrica. Por ejemplo, encontraron que algunas moléculas podían cruzar las membranas más fácilmente de lo esperado por sus características químicas, lo cual implicaba que tenían algún tipo de ayuda. Así que se introdujo a las proteínas como parte de las membranas y como responsables de esos nuevos datos experimentales. H. Davdson y J.F. Danielli propusieron un modelo trilaminar de la membrana incorporando a las proteínas a la bicapa lipídica. Colocaron a las proteínas recubriendo la bicapa lipídica, es decir, tapizando ambas superficies, intentando que cumplieran las leyes termodinámicas (Figura 2).

Hasta que se pudieron observar las primeras muestras biológicas con el microscopio electrónico nadie pudo asegurar como estaba estructurada la membrana celular. Esto ocurrió en los años 1950. El modelo trilaminar de Davdson y Danielli se vio reforzado por las imágenes de microscopía electrónica. Aunque el microscopio electrónico apareción hacia 1930, no fue hasta 1950 que se pudieron observar membranas con nitidez. En los años 50, 60 y 70 del siglo pasado, se consiguieron imágenes de membranas cortadas transversalmente en las cuales aparecían tres líneas: dos líneas oscuras, separadas por una zona clara. Esta imagen se observó en todas las membranas de la célula y en todas las células estudiadas. Por ello, a esta organización oscuro-claro-oscuro se le denominó unidad de membrana, y se consideró universal para cualquier membrana celular. En esta época se midió el espesor de la membrana, 6-8 nm y J.D. Robertson (1960) propuso que la zonas oscuras correspondían a las proteínas y partes hidrofílicas y la zona central clara a las cadenas de lípidos. Cuando se sintetizaron membranas artificiales y se vieron con el microscopio electrónico se comprobó que también poseían la unidad de membrana, incluso sin proteínas. El modelo de Davson y Danielli, que fue popular hasta los años 60 del siglo pasado. coexistió con otros en los que los lípidos y proteínas se colocaban en diferente disposición pero siempre proteínas cubriendo la superficie de la membrana. A pesar de ello no se explicaba muy bien como los iones y otras moléculas cargadas podían cruzar la membrana.
En 1966, Green y Benson, trabajando con liposomas de mitocondrias, descubrieron que se podían extraer trozos, subunidades, de membranas con lípidos y proteínas, luego sugirieron que los lípidos podían ser solventes de proteínas globulares. En esos mismos años también se propuso que algunas proteínas podrían incluso cruzar la membrana actuando como poros. Esto fue debido a que a medida que mejoraron las técnicas de separación de tipos de membrana se pudieron estudiar por separado sus composiciones químicas y se comprobó que era muy variable. Por ejemplo, había membranas con una tasa de lípidos respecto a las proteínas que podía variar desde el 50% al 80%. Por otro lado, muchas proteínas de membrana eran muy insolubles por lo que no se explicaba que fueran sólo periféricas en medio acuoso. Es decir, en las membranas había muchas proteínas y éstas no era probable que fueran sólo periféricas, sino que deberían formar parte de la membrana con las porciones de sus cadenas con aminoácidos localizadas entre las cadenas de ácidos grasos y otras porciones hidrofílicas saliendo por ambos lados de la membrana. Además, desde 1945, la integración de las proteínas en la bicapa lipídica se benefició de los estudios de iones en los que se propuso que el mantenimiento de diferentes concentraciones de éstos a ambos lados de la membrana era debida a una posible bomba que los propulsaba con consumo de energía. Hacia 1965 se encontró que las ATPasas estaban asociadas a las membranas. Estas proteínas usaban ATP para mover iones, luego debían ser transmembrana. Había otros problemas. ¿por qué unos azúcares se se incorporaban a la células mejor que otros?¿Por qué se saturaba el proceso de incorporación? Una posibilidad era la existencia de proteínas transmembrana.
En la década de los 70 del siglo pasado dos líneas de investigación mostraron evidencias de que había proteínas insertadas en las membranas. Una era el desarrollo de la microscopía electrónica de barrido. En 1963, Moor y Mühlethaller desarrollaron la técnica de criofractura para el microscopio electrónico. Y unos años más tarde se observó en el interior de las membranas unas estructuras globulares que no podían ser más que proteínas. La otra eran los estudios moleculares. En 1966 algunos trabajos indicaron que las proteínas no eran globulares, sino que podrían tener disposiciones más alargadas y que podrían insertarse en las membranas. Se podían distinguir dos dominios de la misma molécula, uno era intracelular y el otro extracelular, lo que sólo podía explicarse si dicha molécula atravesaba completamente la membrana plasmática.
En 1972, S.J. Singer y G. Nicolson (Science 175: 720-731), recogieron la información acumulada en la década anterior: movimiento flip-flop limitado de lípidos y nulo para las proteínas, difusión lateral de las moléculas, barrera permeable, proteínas con estructuras en alfa hélice, globulares y transmembrana, transiciones de fase de la membrana, y la necesidad que algunas enzimas tenían de los lípidos para su actividad. Con todo ello propusieron el modelo de mosaico fluido de membrana (Figuras 2 y 3) para incorporar todos estos datos nuevos (ver Figura 1 de Nicolson 2014). Uno de sus grandes ventajas era que recurría a la termodinámica, fuerzas electro-químicas, para explicar la organización de la membrana. Esto suponía que no sólo explicaba sino que predecía las propiedades de la membrana. Propusieron que las membranas están formadas por proteínas embebidas en una bicapa lipídica (de ahí la palabra mosaico). Las proteínas se incorporan a la bicapa y tienen dominios intra y extracelulares. Esto es importante porque establece una vía de comunicación entre el interior y el exterior celular, bien mediante la creación de canales hidrofílicos, bien como elementos transportadores que permiten salvar la barrera de cadenas de ácidos grasos, o bien como receptores que transmiten la información mediante cambios de conformación de la propia estructura molecular frente a señales. A este modelo se le incorporaron posteriormente las proteínas periféricas, tanto las unidas convalentemente a la membrana como las asociadas mediante enlaces eléctricos. Singer y Nicolson ya sugirieron que la interacción entre lípidos y proteínas debía ser funcionalmente importante para la membrana. El término fluido fue otro gran avance conceptual y se propuso como consecuencia de los datos aportados por trabajos previos. H.M. McConell y D. Chapman realizaron experimentos de resonancia magnética en los que se mostraba que las moléculas de las membranas, tanto lípidos como proteínas, no estaban estáticas sino podían moverse lateralmente en la bicapa por difusión, con lo cual la membrana se transformó en una estructura dinámica y maleable. Incluso en estos experimentos se sugirió que la membrana es asimétrica, es decir que la monocapa citosólica tenía una composición diferente a la monocapa externa.
Este modelo de mosaico fluido ha explicado los datos experimentales conseguidos con otras técnicas actuales. Así, con la llegada de los marcajes selectivos de moléculas y su observación en tiempo real con microscopía de fluorescencia se pueden observar moléculas individuales en membranas íntegras y en condiciones más o menos fisiológicas. Se puede comprobar que las moléculas no están fijas en una posición sino que pueden moverse por la bicapa lipídica. Mediante espectroscopía cuantitativa se ha observado que los movimientos son sobre todo laterales, es decir, desplazamientos como si la molécula estuviera flotando en la bicapa lipídica, pero las inversiones o cambios de una monocapa a la otra de la membrana son muy infrecuentes.
Actualmente, el modelo se ha ido modificando y ajustando a los nuevos datos experimentales, que indican que la característica preponderante de la membrana es heterogeneidad, más que fluidez (Figura 3). Por ejemplo, mediante el seguimiento del movimiento de moléculas en células in vivo, y posteriormente in vitro, se ha encontrado que los movimientos de las moléculas no son completamente al azar, es decir, hay restricciones al movimiento. Estas restricciones son evidentes para las proteínas, pero más recientemente también se han encontrado restricciones a los lípidos, afectando principalmente a los esfingolípidos y al colesterol. Así, la membrana se ajusta al modelo de mosaico fluido en que las moléculas tienden a difundir lateralmente de forma libre, pero ese movimiento puede estar sometido a restricciones. Las restricciones a la movilidad de las moléculas de la membrana se agrupan en tres categorías: dependientes de las interacciones físico-químicas entre las propias moléculas, de las interacciones con el citoesqueleto o con la matriz extracelular y dependientes de las propiedades físicas de la propia membrana, fundamentalmente grosor y curvatura. Estas restricciones hacen que la membrana no sea homogénea sino que las moléculas se distribuyan y agrupen en áreas de la superficie celular para formar los llamados dominios de membrana. Estos dominios tendrían una composición molecular característica que le permitirían llevar a cabo diferentes funciones. Por tanto el modelo de membrana actual está basado en el modelo de mosaico fluido, pero curiosamente, la posibilidad de difusión de las moléculas no produce una homogeneidad química de la membrana sino todo lo contrario, una heterogeneidad de dominios distribuidos por toda la extensión de la membrana. Cada uno de estos dominios, del orden de nanometros, puede variar su posición, su número, su tamaño (pocas decenas de nanométros de extensión), aparecer y desaparecer en intervalos de tiempo cortos, y todo ello según las necesidades funcionales de la célula. La fluidez, paradójicamente, favorece la formación y la dinámica de estos dominios.
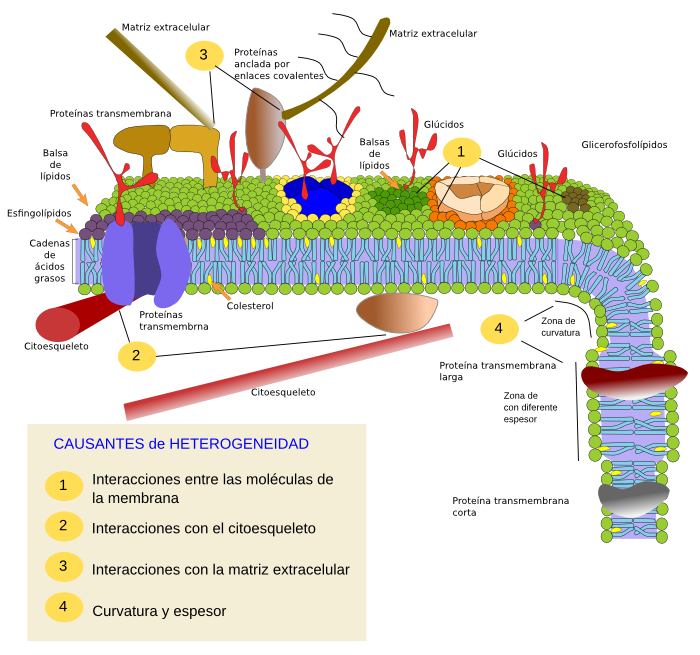
Hay numerosos datos con técnicas recientes que probablemente nos harán dibujar a las membranas de manera diferente a como aparecen actualmente en la mayoría de los libros de texto.
Más proteínas. Por ejemplo, en las representaciones de la membrana las proteínas están a baja concentración, dispersas y aisladas entre los lípidos. Pero las membranas están llenas de proteínas, que interaccionan entre sí, y además varían considerablemente en grosor. Hay que tener en cuenta que una membrana plasmática tipo tiene hasta un 50 % del peso de proteínas. Se estima que hay una proteína por cada 40 lípidos. Debido al pequeño tamaño de los lípidos se calcula que hay sólo de uno a dos nanometros de distancia entre las proteínas. En realidad es muy probable que las proteínas formen grandes complejos macromoleculares, y que, mediantes sus anclajes a citoesqueleto y matriz, y las interacciones entre ellas, puedan actuar como un esqueleto para las propias membranas.
Espesor irregular. En cuanto al espesor de la membrana, se podría pensar que la evolución ha llegado a producir proteínas transmembrana cuyo segmento hidrófobo se ajuste al espesor de la zona de ácidos grasos de la membrana, pero esto no es así. Hay proteínas con zonas hidrófobas más largas que otras y, por tanto, para quedar protegidas dentro de la membrana los lípidos deben ajustarse para cubrirlas, lo que hará mebranas más gruesas según la zona (Figura 4).

Superficies asimétricas. Mediante el uso de microscopios de fuerza atómica se pueden estudiar la superficies de membranas del orden de nanometros, todo ello con libre movimiento de las moléculas. El estudio de la membrana de los eritrocitos ha arrojado datos curiosos. Por ejemplo, la superficie externa es muy lisa, lo que indica que ni el glicocálix ni el dominio extracelular de las proteínas sobresalen mucho más allá de la capa de cabezas hidrofílicas de los lípidos de membrana. La barrera externa sería una capa hidrofílica compuesta por las cabezas de los fosfolípidos, dominos proteicos extracelulares y los azúcares que se situarían entre ellas. Sin embargo, la parte interna es tiene muchos altibajos, que se achacan a los dominios intracelulares de las proteínas (Figura 5).
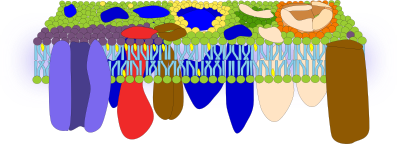
Una aproximación similar en membranas celulares de células eucariotas ha revelado que las proteínas son muy abundantes y ocupan la mayor parte de la superficie de la membrana. El dominio proteico extracelular es de unos 4 nm, por encima de la cabeza de los lípidos. Hay tantas proteínas y tan empaquetadas que se forma una superficie muy homogénea. Se puden detectar zonas ricas en colesterol y los azúcares parecen concentrarse en microdominios en el lado extracelular. Las proteínas transmembrana se colocan asimétricamente en la membrana, con una parte mucho mayor en el dominio citosólico. De hecho, el lado citosólico de las proteínas se extiende unos 10 a 12 nm desde las cabezas de los lípidos. Las proteínas del lado citosólico se agregan en microdominios ricos en colesterol. Estos dominios están separados unos 13 a 105 nm, y miden unos 53 nm. Hay que tener en cuenta que la capa de lípidos mide unos 4 nm de espesor, por lo que todo esto resulta en un grosor de membrana de unos 20 nm (Figura 6). Este modelo supone que existe un barrera protectora externa básicamente formada por proteínas. Los microdominios de las proteínas transmembrana indican que las proteínas trabajan en grupos a modo de plataformas que aumentan la probabilidad de interacción entre proteínas y por tanto la eficiencia.

Bibliografía
Alberts A, Johnson A, Lewis J, Raff M, Roberts K, Walter P. 2007. Molecular Biology of the Cell. 5th editon. Garlan Science. ISBN: 9780815341055.
Bagatolli LA, Ipsen JH, Simonsen AC, Mouritsen OG 2010. An outlook on organization of lipids in membranes: Searching for a realistic connection with the organization of biological membranes. Progress in lipid research. 49: 378–389.
Becker WM, Kleinsmith LJ, Hardin J, Raasch J. 2003. The world of the cell. 6th. San Francisco: Benjamin Cummings. ISBN-10: 0321716027 ISBN-13: 9780321716026.
Edidin M. 2014. Lipids on the frontier: a century of cell-membrane bilayers. Nature reviews molecular cell biology. 9:32.
Engelman DM. 2005. Membranes are more mosaic than fluid. Nature. 438:578-80.
Lombard J. 2003. Once upon a time the cell membranes: 175 years of cell boundary research. Biology direct. 4(5), 414-418.
Nicolson GL. 2014. The Fluid—Mosaic Model of Membrane Structure: Still relevant to understanding the structure, function and dynamics of biological membranes after more than 40years. Biochimica et Biophysica Acta (BBA)-Biomembranes. 1838(6), 1451-1466.
Pollard TD, Earnshaw WC, Lippincott-Schwartz J. 2007. Cell biology. 2th edition. Saunders Elsevier Inc. ISBN: 978-1-4160-2255-8.
Wang H, Hao X, Shan Y, Jiang J, Cai M, Shang X 2010. Preparation of cell membranes for high resolution imaging by AFM. Microscopy. 110: 305-312.
Zhao W, Tian Y, Cai M, Wang F, Wu J, Gao J,
Liu S, Jiang J, Jiang S, Wang H. 2014. Studying the nucleated mammalian cell membrane by single molecule approaches. PLOSone. 9 (5):e91595.
