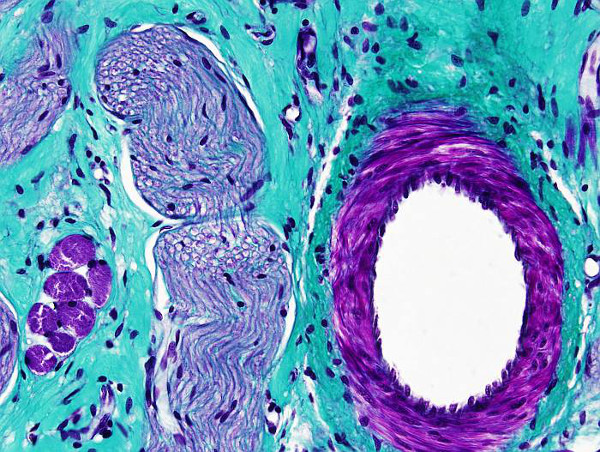
Como su nombre indica, esta tinción emplea tres colorantes. Son la hematoxilina, la fucsina y el verde luz. Es muy útil para poner de manifiesto las fibras de colágeno, y el conectivo en general, en comparación con las células musculares o epitelios. Se emplea mucho en la diagnosis de procesos tumorales. Hay muchas variantes de esta tinción adaptadas a las necesidades particulares de cada laboratorio.
Procedimiento
Protocolo modificado por Serxio Fernández Fidalgo.
Partimos de muestras que han sido fijadas en solución de Bouin e incluidas en parafina. Se han obtenido secciones de unas 8 µm adheridas a portaobjetos recubiertos con gelatina.
1. 2x10 min en xileno para desparafinar
2. 2x10 min en etanol 100º
3. 10 min en etanol 96º
4. 10 min en etanol 80º
5. 10 min en etanol 50º
6. 5 min en H2O destilada
Si el tejido no se ha fijado con BOUIN es recomendable sumergir las secciones en solución de Bouin, el cual actúa como mordiente, durante 24 h a temperatura ambiente o 1 h a 56 - 60 ºC.
7. 3x3 min en H2O destilada.
8. 5 min en Hematoxilina férrica de Weigert (10 min si el colorante lleva más de 5 días hecho).
9. 5 min en agua corriente para diferenciación.
Cuando se aprecie el viraje de color se puede comprobar si la tinción es adecuada al microscopio, pudiendo volver a meter las muestras en la hematoxilina si no es suficientemente intensa.
10. 3 min lavado en H2O destilada.
11. 5 min en fucsina-escarlata.
Preparación de Fucsina-Escarlata:
90 ml de Escarlata de Biebrich (C.I. 26905) al 1% en H2O destilada.
9 ml de fucsina ácida (C.I. 42685) en solución acuosa al 1% en H2O destilada.
1 ml de ácido acético glacial.
12. 2 min lavado en H2O destilada.
Este es otro paso en el que se puede comprobar si la coloración es satisfactoria, teniendo en cuenta que tendrá un color algo más oscuro e impreciso ya que la diferenciación se realiza varios pasos más adelante. Si la tinción es muy clara se devuelven las muestras a la fucsina-escarlata, pero si es excesiva, con dejar las muestras en agua más tiempo es suficiente para decolorar, ya que se va perdiendo colorante con el tiempo.
13. 15 min en ácido fosfomolíbdico al 5% en agua destilada.
Es imprescindible para que el verde luz tiña correctamente el tejido. Es recomendable que la disolución de ácido fosfomolíbdico sea fresca y usarla muy pocas veces. Este paso también elimina color de la fucsina-escarlata de las secciones por lo que hay que tenerlo en cuenta en los pasos previos. Si no se ve una buena tinción se puede volver a pasos anteriores.
14. 10 min en verde luz (CI 42095) al 2 % (puede ser sustituido por azul de anilina).
Verde luz (CI 42095) 2 g más ácido acético glacial 2 ml en 100 ml de H2O destilada.
15. Unos segundos en agua destilada.
Podremos distinguir a simple vista si el tejido ha captado suficiente colorante, o también se puede observar al microscopio si se prefiere. En caso de que no se haya teñido adecuadamente se puede retroceder sin problemas y volver a teñir con verde luz, pero siempre pasando antes por el ácido fosfomolíbdico. Si la tinción es excesiva no hay mayor problema ya que la diferenciación con agua acidificada y el alcohol de 96º con el que se comienza la deshidratación van reduciendo el verde luz. Así que con alargar estos pasos sería suficiente.
16. 3 min de diferenciación con ácido acético al 1% en H2O destilada.
Con 1 min es suficiente si las muestras no llevan un exceso de verde luz. Más tiempo puede decolorar demasiado.
17. Deshidratado rápido, unos segundos, en etanol de graduación creciente: 80º, 96º y 100º
El paso de etanol de 96º debe durar sólo unos pocos segundos, comprobando siempre que las partes teñidas con fucsina-escarlata vayan virando adecuadamente a un color mas rosado y claro, pero no demasiado tiempo ya que decoloraría demasiado las partes teñidas con verde luz. Para un buen contraste es imprescindible realizar bien este paso. Si por cualquier razón la tinción no nos parece adecuada se puede volver atrás y repetir cualquiera de los pasos con colorantes, incluso desde la hematoxilina pero siempre continuar a partir de ese paso siguiendo todos los demás. Como las muestras se habrán deshidratado un poco con el alcohol de 96º antes de nada habrá que meterlas en H2O destilada para rehidratarlas y poder volver a pasos anteriores.
18. 2x10 min en xileno.
19. Montado con medio de montaje.
Resultados
Colágeno: verde azulado.
Músculo: rojo, marrón.
Citoplasma: rosado.
Núcleos: negro.
Consejos
En este protocolo se puede volver hacia atrás sin problemas, pero no más de tres o cuatro veces puesto que el tejido va perdiendo la capacidad de retener los colorantes.
Productos
Xileno
Etanol de 50º, 70º, 80º, 90º, 96º y 100º
Hematoxilina férrica de Weigert
Escarlata de Biebrich (C.I. 26905)
Fucsina ácida (C.I. 42685)
Ácido fosfomolíbdico al 5 %
Verde luz (CI 42095)
H2O destilada
H2O corriente
Medio de montaje
Material
Cubetas de tinción
Cesta para portas
Cubreobjetos