1. Semipermeabilidad
2. Fluidez
3. Heterogeneidad
- Internas
- Externas
- Curvatura, espesor
La composición química de las membranas hace que posean unas propiedades esenciales para la célula. En esta página veremos tres de ellas: la permeabilidad, la fluidez y la heteorgeneidad latera.
1. Semipermeabilidad
Esta propiedad es consecuencia del ambiente hidrófobo interno de la membrana creado por las cadenas de ácidos grasos de los lípidos, difícil de cruzar por las moléculas con carga eléctrica neta. Permite a las membranas crear compartimentos intracelulares o mantener separados el medio intracelular del extracelular y, por tanto, impedir la libre difusión de diversos tipos de moléculas a su través. Sin embargo, la permeabilidad es selectiva. Las variables que más influyen en la difusión pasiva son la polaridad y el tamaño de la molécula (Figura 1). Incluso el agua tiene algunas restricciones al cruzar las membranas. Por otro lado, las membranas son altamente impermeables a los iones y a las moléculas que también carga neta.

La desigual distribución de iones y moléculas entre ambos lados de la membrana es la base para la creación de los gradientes químicos y eléctricos. La medida de esa diferencia de concentración de cargas es lo que se llama potencial de membrana, que se usa para muchas funciones celulares, como por ejemplo la síntesis de ATP o la transmisión del impulso nervioso. La semipermeabilidad de la membrana también permite el fenómeno de la ósmosis, es decir, el flujo de agua hacia donde más concentración de solutos haya. Las células vegetales deben su crecimiento a este proceso. Las moléculas que no cruzan las membranas libremente son interesantes para las células puesto que la variación de sus concentraciones a un lado u otro de la membrana puede actuar como señales o como alamcén de energía. Por ello se han inventado proteínas integrales de membrana que permiten selectivamente el paso de estas sustancias de un lado al otro. La permeabilidad de las membranas también dependen de la composición de lípidos, particularmente el colesterol. Membranas más fluidas (ver más abajo) suelen ser más permeables, y al contrario, las menos permeables son menos fluidas.
2. Fluidez
La fluidez es la capacidad de una molécula que forma parte de una membrana para desplazarse por ella. Habría dos posibilidades de movimiento para los lípidos: uno lateral donde se desplazaría entre las moléculas contiguas de la misma hemicap, y otro en el que saltaría a la otra hemicapa, movimiento denominado "flip-flop" (Figura 2). El primero es mucho más frecuente que el segundo, debido a que las cabezas polares de los lípidos se encuentran con la barrera de las cadenas de ácidos grasos.

La fluidez de la membrana puede variar con su composición química. Así, generalmente, la menor longitud o la mayor cantidad de enlaces insaturados de las cadenas de ácidos grasos hacen que las membranas sean más fluidas. El colesterol también influye en la fluidez de la membrana, pero su efecto depende de las condiciones de temperatura y composición lipídica de la membrana. En general se puede decir que una mayor concentración de colesterol disminuye la fluidez de la membrana plasmática. Sin embargo, las bajas temperaturas disminuyen la fluidez de la membrana y en estas condiciones el aumento de la concentración de colesterol favorece la fluidez. Un efecto adicional de la concentración de colesterol es que aumenta la hidrofobicidad, es decir, las membranas se vuelven más impermeables.
Las células pueden alterar la fluidez de sus membranas modificando la composición química de éstas. Las mitocondrias cuentan con la cardiolipina, un fosfolípido muy insaturado que aumenta la hidrofobicidad, evitando una excesiva disminución de la fluidez.
3. Heterogeneidad lateral
Debido a la fluidez de la membrana podría pensarse que las moléculas están distribuidas al azar y que por tanto la membrana sería homogénea. Esto no es así puesto que hay diversas restricciones a las movilidad lateral de las moléculas que hacen que la membrana sea heterogénea.
Las restricciones a la movilidad pueden ser causadas por diferentes mecanismos como interacción con moléculas del citoesqueleto o la matrix extracelular, interacciones moleculares entre las propias moléculas de la membrana, densidad (menor fluidez local), concentración de cargas eléctricas, y grado de curvatura de la membrana o espesor de la misma (Figura 3).
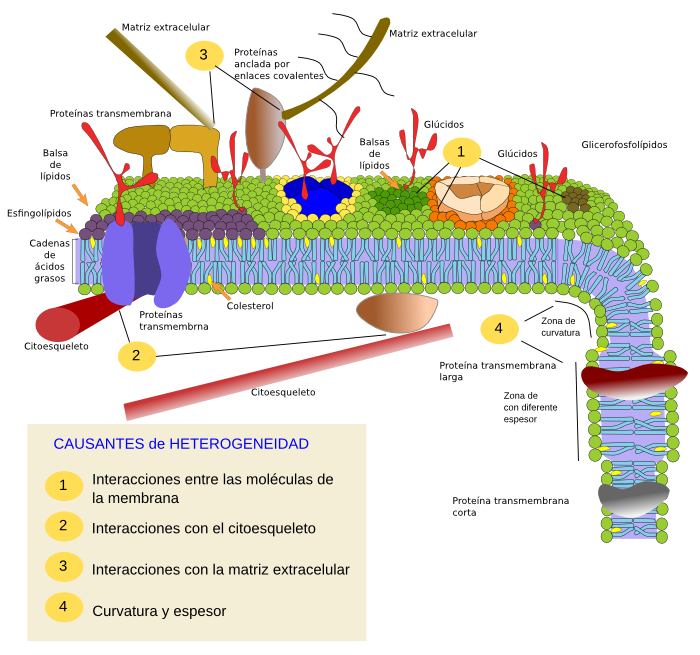
Interacciones moleculares internas
Una restricción al movimiento de las moléculas se debe a las interacciones y asociaciones moleculares entre las propias moléculas de las membranas (Figura 4). Esto afecta tanto a las proteínas como a los lípidos.

Los esfingolípidos y el colesterol se pueden asociar entre sí espontáneamente haciendo que su movilidad disminuya y por tanto se conviertan en una región membranosa más densa que el resto, como si de una balsa en un mar se tratara. Se cree que estas asociaciones, denominadas balsas de lípidos ("lipid rafts"), son muy abundantes y dinámicas y hacen que las membranas celulares sean en realidad un mosaico de dominios más densos que viajan entre los glicerofosfolípidos, más fluidos.
En la hemicapa interna de la membrana plasmática también se forman microdominios provocados por interacciones electrostáticas entre las proteínas que tienen dominios citosólicos básicos y/o cationes divalentes y las cabezas polares de lípidos cargadas negativamente. Las proteínas integrales o asociadas a la membrana también pueden interaccionar entre sí y pueden ensamblarse en estructuras macromoleculares que favorezcan la transmisión de señales, reconocimiento celular, activación enzimática, movimiento celular, etc.
Interacciones externas con el citoesqueleto y la matriz extracelular
Las proteínas integrales de membrana tienen numerosas restricciones a la movilidad, principalmente por culpa de las interacciones de sus dominios intra y extracelulares con moléculas del citoesqueleto y de la matriz extracelular, respectivamente (Figura 5). Estas interacciones anclan por tiempos más o menos prolongados las proteínas de membrana a lugares concretos de la superficie celular. Otra posibilidad es crear territorios a modo de cercados, donde las cercas son los filamentos del citoesqueleto, de manera que, sobre todo las proteínas, queden confinadas a regiones pequeñas delimintadas por el citoesqueleto. Las células tienen otros mecanismos para confinar proteínas a determinados dominios celulares.

Curvatura y espesor
Curvar una membrana es otra manera de crear dominios, y esta curvatura puede ser el proceso inicial de la formación de una vesícula, la extensión de una expansión celular, el cambio o crecimiento de un orgánulo, o simplemente un pliegue. En cualquier caso la curvatura de la membrana actúa como una barrera a las difusión lateral de moléculas.
La maquinaria necesaria para curvar una membrana requiere a su vez un dominio de membrana para llevarlo a cabo. Determinadas composiciones lipídicas o zonas con diferente carga eléctrica son sitios de atracción para dicha maquinaria. Los fosfoinosítidos son lípidos que participan en este reclutamiento de las proteínas que curvan a las membranas de manera efectiva (Figura 6).

Otros dominios físicos de las membranas, creados por moléculas presentes en la propia membrana, son regiones de diferente espesor o altura (Figura 7). Son formados por proteínas transmembrana que tienen el dominio hidrofóbico más largo de lo habitual y por tanto se acomodan mejor en la membrana cuando se rodean de lípidos con cadenas de ácidos grasos largos.

-
Bibliografía ↷
-
Bibliografía
Honigmann A, Pralle A. 2016. Compartmentalization of the cell membrane. Journal of mollecular biology. 428: 4739-4748.
Jacobson K, Liu P, Lagerholm BC. 2019. The lateral organization and mobility of plasma membrane components. Cell. 177: 806-819. DOI: 10.1016/j.cell.2019.04.018.
Jarsch IK, Daste F, Gallop JL. 2014. Membrane curvature in cell biology: an integration of molecular mechanisms. Journal of cell biology. 214: 275-387
Nicolson GL. 2014. The Fluid—Mosaic Model of Membrane Structure: Still relevant to understanding the structure, function and dynamics of biological membranes after more than 40 years. Biochimica et biophysica acta. 1838: 1451-1466.
Subczynski WK, Pasenkiewicz-Gierula M, Widomska J, Mainali L, Raguz M. 2017. High cholesterol/low cholesterol: effects in biological membranes: a review Cell biochemstry and biohysic. https://doi.org/10.1007/s12013-017-0792-7
-
 Glúcidos
Glúcidos