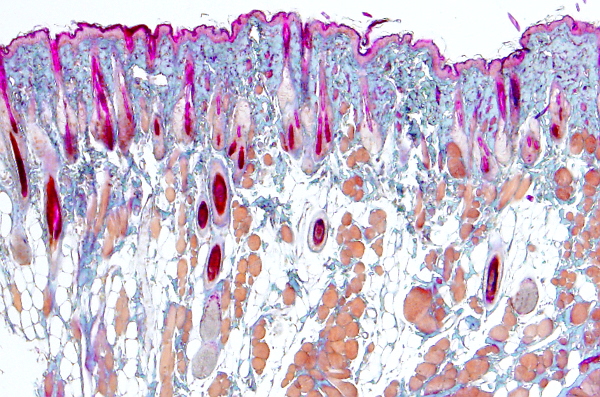
Este método es una modificación de la tinción tricrómica de Mallory. Su ventaja es que diferencia una mayor diversidad de estructuras histológicas, sobre todo por la obtención de imágenes nucleares con diferente coloración. El protocolo debe adaptarse a cada tipo de material, siendo necesarios ensayos previos.
Procedimiento
Partimos de muestras que se ha fijado y se han incluido en parafina. Estas muestras se han cortado en secciones de unas 8 µm y se han adherido a portaobjetos recubiertos con gelatina. Cuando los cortes provienen de material que ha sido fijado con un fijador que contiene ácido pícrico hay que eliminarlo mediante incubación en alcohol con anilina (1% de anilina en etanol de 96º) durante 30 minutos.
1.- Xileno para desparafinar, 2x10 min.
2.- Etanol 100º, 2x10 min.
3.- Etanol 96º, 10 min.
4.- Etanol 80º, 10 min.
5.- Etanol 50º, 10 min.
6.- H2O destilada, 5 min.
7.- Azocarmín previamente calentado a 60 ºC durante, 1 h a 60 ºC.
Azocarmín G
0.1 g de azocarmín G (C.I. 50085)
200 ml H2O destilada
2 ml de ácido acético
8.- H2O destilada, varios lavados.
9.- Diferenciar bajo el microscopio mediante inmersiones sucesivas en alcohol-anilina (anilina (C.I. 76000) al 0.1 % en etanol 96º).
La velocidad de diferenciación es proporcional a la cantidad de anilina y a la concentración del alcohol. Según el resultado deseado, puede modificarse la composición de la mezcla alcohol-anilina, desde alcohol de 70º con un 1% de anilina, hasta el alcohol de 96º con un 0,1% de anilina.
10.- Detener la diferenciación con etanol-acético (ácido acético al 1% en etanol 96º)
11.- H2O destilada, varios lavados.
12.- Ácido fosfotúngstico al 5%, 1 hora.
Este ácido actuará como mordiente y favorece la tinción con el azul de Heidenhain, al mismo tiempo que continúa la diferenciando el azocarmín.
13.- H2O destilada, varios lavados.
14.- Azul de Heidenhain, 2 h.
Azul de Heidenhain
0.2 g de azul de anilina (C.I. 42755)
0.5 g de naranja G (C.I. 16230)
100 ml de H2O destilada
1 ml de ácido acético
15.- Etanol 96º, una inmersión rápida.
16.- Etanol 100º, varias inmersiones rápidas.
17.- Xileno, 2x10 min.
Resultados
Núcleos: distinta coloración, desde naranja a rojo
Citoplasma: coloración diversa
Músculo: naranja a rojo
Colágeno: azul
Consejos
Hay que modificar el protocolo según la muestra con el que se esté trabajando.
Son críticos los pasos de diferenciación.
La deshidratación final ha de ser muy rápida para no perder la coloración azul.
Productos
Xileno
Etanol de 50º, 80º, 90º, 96º y 100º
Azocarmín G (C.I. 50085)
Anilina (C.I. 76000)
Azul de anilina (C.I. 42755)
Naranja G (C.I. 16230)
Ácido fosfotúngstico
Ácido acético
H2O destilada
Medio de montaje
Material
Cubetas de tinción
Estufa a 60 ºC
Cesta para portas
Cubreobjetos