La inmunohistoquímica es una técnica para la localización de moléculas en los tejidos mediante el empleo de anticuerpos. Es una técnica que gracias a la oferta comercial de anticuerpos y a la estandarización de su protocolo se ha convertido en un método sencillo, rápido y muy potente. Se basa en la gran especificidad y alta afinidad que tienen los anticuerpos para reconocer a moléculas y unirse a ellas. Además, la conjugación o combinación de los anticuerpos con enzimas o con sustancias fluorescentes permite detectar cantidades ínfimas de moléculas presentes en el tejido.
Los anticuerpos (inmunoglobulinas) que se usan en las técnicas inmunohistoquímicas son del tipo G, producidas por unas células del sistema inmunitario denominadas linfocitos B durante la respuesta inmune. La producción masiva de anticuerpos se da en un animal cuando le inyectamos una molécula que reconoce como extraña. Estos anticuerpos pasan a formar parte del suero sanguíneo, el cual se extrae del animal inmunizado, y del que posteriormente se purifican. Dichos anticuerpos purificados se usarán posteriormente en la técnica inmunohistoquímica (Figura 1).
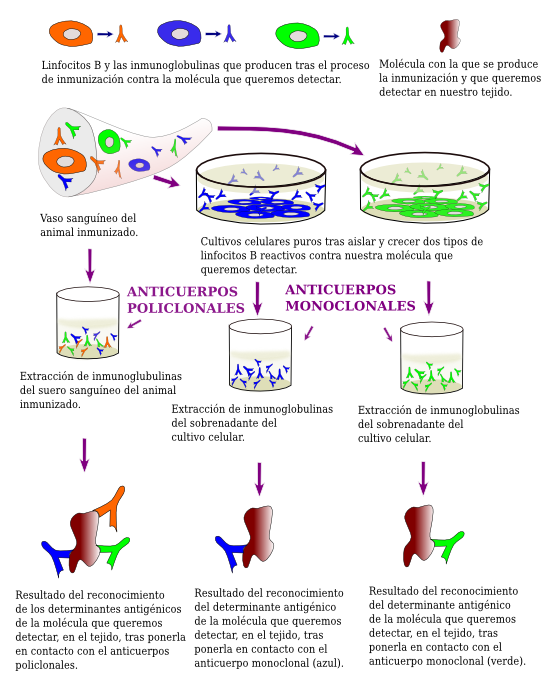
Las moléculas complejas como las proteínas pueden tener en su estructura varios determinantes antigénicos, es decir, lugares que son capaces de desencadenar una respuesta inmune. Ello supone que cada determinante antigénico es capaz de activar un clon de linfocitos B, es decir, un linaje de linfocitos B que producirá un mismo tipo de inmunoglobulina G contra dicho determinante antigénico. Los anticuerpos de todos los clones de linfocitos B activados por la molécula inyectada irán a parar al suero sanguíneo (Figura 1). Cuando se emplean sueros purificados de este tipo en inmunohistoquímica se dice que se están empleando anticuerpos policlonales. Por otra parte, existe una técnica que permite aislar y cultivar en el laboratorio (in vitro) de forma individualizada a cada uno de los clones de linfocitos B activados durante la respuesta inmune. Cada uno de esos cultivos producirá un solo tipo de inmunoglobulina G que reconocerá sólo a uno de los determinantes antigénicos de la molécula inyectada. A los anticuerpos obtenidos de cada uno de esos cultivos se les denomina monoclonales ya que proceden de linfocitos que producen inmunoglobulinas idénticas.
Las moléculas de inmunoglobulinas tipo G pueden dividirse en dos dominos: la fracción cristalizable y la variable. El dominio variable es el que se encarga de reconocer al determinante antigénico de nuestra molécula. Hay dos sitios de unión en cada molécula, por lo que cada inmunoglubulina podría reconocer y unir a dos determinantes antigénicos a la vez (estos determinantes han de ser idénticos). La fracción cristalizable tiene una estructura similar para todas las inmunoglubulinas G producidas por los individuos de una misma especie.
Para que un anticuerpo se una a su determinante antigénico localizado en una molécula del tejido procesado, ésta no debe alterarse. De otro modo ese determinante antigénico no será reconocido por el anticuerpo. Por ello el proceso de fijación del tejido debe elegirse para preservar al máximo a la molécula que queremos detectar. Así, se usan diferentes fijadores según el tipo de molécula en la que estemos interesados. También es necesario considerar el método de obtención de los cortes. Inclusiones en parafina pueden dañar las moléculas, por lo que en la mayoría de los casos se suele trabajar con cortes de vibratomo o con secciones obtenidas por congelación.
Las inmunoglobulinas, aunque se unan a la molécula que queramos detectar, no son visibles con el microscopio, por lo que las tendremos que conjugar (unirlas) a otras moléculas que nos den una señal visible. Estas moléculas que aportan visibilidad a los anticuerpos suelen ser de dos tipos: enzimas y moléculas fluorescentes. Las primeras pueden convertir determinadas moléculas solubles e incoloras en productos insolubles y coloreados que se pueden observar con el microscopio, mientras que en las segundas la señal la aporta la sustancia fluorescente.
El método del marcado con sustancias fluorescentes tiene una serie de ventajas que veremos más adelante, pero tiene la desventaja de que no son marcajes permanentes puesto que la luz emitida por la molécula fluorescente se desvanece con el tiempo. Sin embargo, las secciones procesadas con anticuerpos unidos a enzimas pueden deshidratarse, montarse y mantenerse permanentemente para su observación. Las enzimas habituales que se unen a las inmunoglobulinas son la peroxidasa y la fosfatasa alcalina.
La conjugación directa de un marcador (enzima o fluorescente) con la inmunoglobulina que reconoce al antígeno del tejido se denomina método de detección directa (Figura 2). Hoy en día se suele emplear el método de detección indirecta, que consiste en colocar una serie de intermediarios entre la inmunoglobulina y la molécula marcadora.
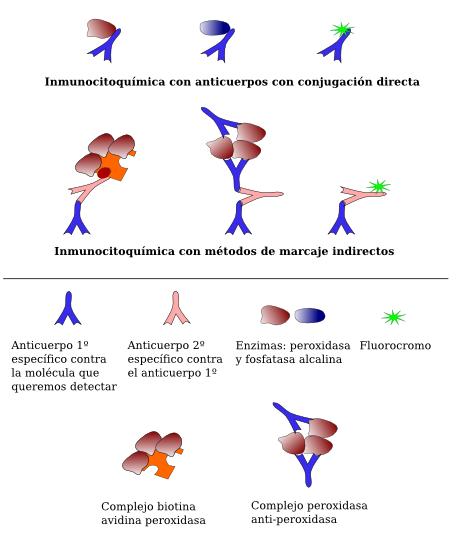
La detección con enzimas es a lo que se denomina inmunocitoquímica o inmunohistoquímica. Inicialmente se emplearon los métodos directos, sobre todo mediante la conjugación de enzimas a la inmunoglobulina. Luego se emplearon métodos indirectos como el denominado peroxidasa-antiperoxidasa (PAP; Figura 2). Actualmente es más frecuente usar el método del complejo avidina-biotina-peroxidasa (ABC; Figura 3). El método indirecto permite una mayor versatilidad de la técnica y mayor intensidad de señal frente a una misma cantidad de antígeno. El procedimiento parte de secciones de tejido previamente fijado. Inmediatamente después se incuban en una solución de bloqueo que satura los posibles sitios de unión inespecífica, gracias a una alta concentración de proteína como la albúmina de suero bovino. Tras cada paso de unión de anticuerpos o del complejo avidina-biotina-peroxidasa se procede a lavar los cortes en una solución tamponadora, en la que también van disueltos los anticuerpos. La reacción de la peroxidasa degrada el peróxido de hidrógeno, liberando electrones que hacen que otra molécula, la diaminobencidina, se transforme en un producto insoluble y coloreado visible con el microscopio óptico (Figura 4).


La inmunofluorescencia se basa en las propiedades de los fluorocromos. No es una inmunohistoquímica puesto que no se produce ninguna reacción química. Los fluorocromos son moléculas que emiten luz visible cuando se les ilumina con una determinada longitud de onda. Hoy en día se suelen emplear protocolos de detección indirecta (Figura 5). Aunque la inmunofluorescencia se puede usar para detectar a una sola molécula tisular, su verdadero potencial se muestra cuando necesitamos una múltiple inmunodetección, es decir, dos o más moléculas presentes en una misma célula o matriz extracelular de forma simultánea (Figura 5 y 6). Esto es posible porque existe una gran variedad de fluorocromos que son capaces de emitir luz visible tras ser excitados con diferentes longitudes de onda, luego seleccionando el intervalo de longitudes onda con el que iluminamos un tejido podemos excitar de modo individual, y secuencial, varios fluorocromos que hayamos usado, unidos a inmunoglubulinas diferentes, para detectar moléculas diferentes. Tomando fotografías tras cada excitación y superponiendo dichas imágenes podemos averiguar si las moléculas se expresan, por ejemplo, en la misma célula (Figura 6).


La capacidad para detectar un antígeno por parte de los anticuerpos puede verse disminuida por numerosos factores: fijación, inclusión, y tratamientos previos como la descalcificación. Generalmente, lo que ocurre es que el antígeno queda enmascarado, a veces destruido, y es inaccesible al anticuerpo. Por ejemplo, la descalcificación del tejido óseo puede conllevar el uso de ácidos fuertes que destruyan los antígenos, o una fijación excesiva crea enlaces moleculares que ocultan los antígenos. En el caso de la descalcificación, es conveniente hacerla con tratamientos que incluyan quelantes de calcio en vez de ácidos, mientras que el enmascaramiento por fijación se solventa con un proceso denominado desenmascaramiento de antígenos.
También se pueden emplear los anticuerpos para detectar antígenos sobre secciones que se van a observar con el microscopio electrónico. Esta observación se puede realizar mediante una immunohistoquímica estándar sobre cortes de vibratomo, pero sin usar detergentes o sustancias que nos alteren las membranas. El precipitado de diaminobencidina es denso a los electrones, por lo que tras la osmificación de las secciones se pueden ver las células y estructuras marcadas con un precipitado oscuro. Para una detección ultraestructural más precisa se pueden marcar los anticuerpos secundarios (Anti-IgG) con pequeñas bolitas de oro, que aparecerán en el microscopio electrónico como puntos negros.
 Lectinas
Lectinas