Las espermatogonias son las células germinales que se encuentran en las gónadas de los animales macho. En los animales cuyos testículos están formados por túbulos seminíferos, las espermatogonias se encuentran en contacto con la lámina basal de esos túbulos (Figura 1). Se denomina espermatogonia a las células germinales masculinas antes de que entren en meioisis.

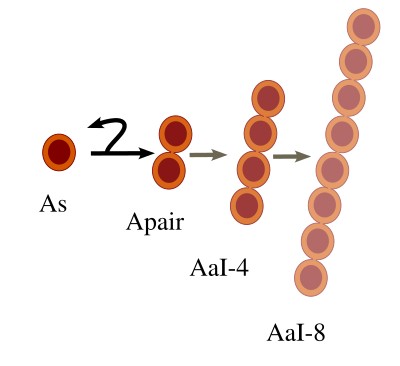
Hay varios tipos de espermatogonias: las espermatogonias indiferenciadas, denominadas genéricamente como A (As, Apair, Aal4, Aal8 y Al16), y las espermatogonias en proceso de diferenciación, o comprometidas, que se denominan A1, A2, A3, A4, ln y B (Figura 2). En las espermatogonias indiferenciadas hay células troncales individuales (As; s de single), y otras que forman sincitios tras divisiones incompletas de los citoplasmas células: Apair (pair: pareja), Aal4 (4 células), Aal8 (8 células) y Aal16 (16 células). Un sincitio es un citoplasma compartido por dos o más núcleos.

1. Modelos
Modelo As
El modelo descrito hasta ahora y que aparece en la figura 3 se denomina modelo As (ver también Figura 1). Según este modelo habría espermatogonias madre (As) que irían dividiéndose simétrica y asimétricamente para dar nuevas As o dar Apair, y estas a AaI-4, y así sucesivamente. Apair estarían conectadas por puentes citoplasmáticas, así como todas sus derivadas, hasta llegar a espermatogonias tipo B que entrarían en meiosis. Una vez que una As decide dar una Apair ya perdería la capacidad de autorrenovación permanente. Este modelo es el más aceptado, aunque se han propuesto dos modelos alternativos recientemente.
Modelo fragmentación
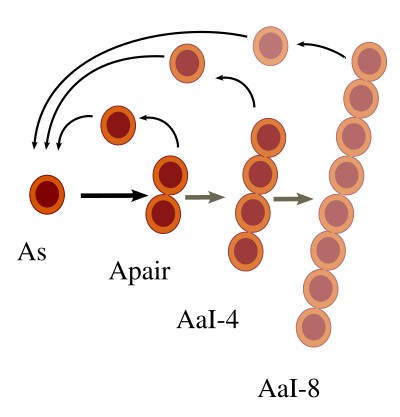
Actualmente hay evidencias de que las espermatogonias indiferenciadas que no son las As pueden desgajarse de sus compañeras y dar lugar a nuevas As que inicien un nuevo sincitio o linaje clonal (Apair, Aal4, etc; representado en la Figura 1). De hecho, las As normalmente forman Apair y no dos As individuales tras su división. Es decir, no habría una población estable de As, sino que éstas se generarían por desgaje de los clones en desarrollo (Figura 3). Sin embargo, la probabilidad de que eso ocurra disminuye a medida que el sincitio aumenta de tamaño. Es decir, es menos probable en Aal16 que en Apair. Por otra parte las espermatogonias en diferenciación ya no tienen vuelta atrás. Sin embargo, este modelo no es capaz de explicar todos los resultados que se conocen sobre el comportamiento de las espermatogonias As.
Modelo jerárquico
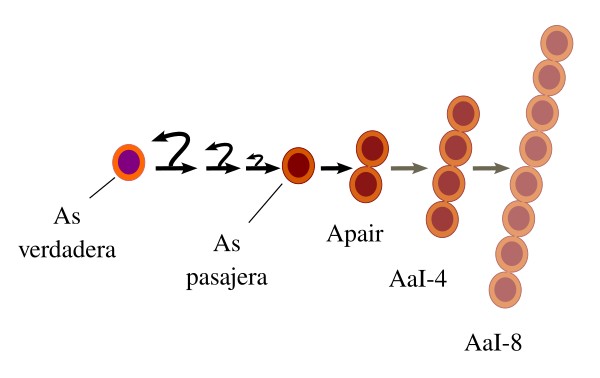
Este modelo se basa en los recientes descubrimientos de que las espermatogonias As podrían ser heterogéneas respecto a su capacidad de autorrenovación, la cual se iría restringiendo progresivamente según el subtipo de As. Hay una subpoblación de As que expresan el factor ID4, el cual es necesario para la autorrenovación (Figura 5). Curiosamente las células que expresan ID4 no se encuentran en los lugares o nichos (ver más abajo) donde suelen aparecer los clones de espermatogonias que se convertirán en espermatozoides. xAdemás, los niveles de ID4 no son similares en todas las As, y no aparece en las Apair y sucesivas. Se atribuye una mayor capacidad de autorrenovación a aquellas con más expresión de ID4. Otros marcadores que también se expresan irregularmente en las As y que su presencia es indicio de mayor capacidad de autorrenovación son el Pax7 y BMI1. Las As que expresan mucho ID4 se consideran como las verdaderas espermatogonias troncales, mientras que las que expresan bajos niveles se han denominado espermatogonias troncales temporales. La cantidad de espermatogonias troncales verdaderas respecto a las temporales podría ser de 1/5 o menor.
2. Diferenciación
La transición de espermatogoina A a A1 implica el compromiso de llevar a cabo la meiosis, luego aunque las espermatogonias A1 a B se pueden dividir por mitosis, ya están predestinadas a entrar en meoisis y se convertirán en espermatozoides (Figura 1). Por eso se les denomina espermatogonias en proceso de diferenciación o comprometidas. Como todas las células madre de los tejidos, las espermatogonias tipo A son muy escasas, en ratones representan 0.03 % de todas las células germinales del testículo.
La transición de A a A1 necesita a la vitamina A, en forma de ácido retinoico, como señal para que tenga lugar. El ácido retinoico puede ser liberado por las células de Sertoli, aunque también por las células germinales. Se ha postulado que el inicio de la espermatogénesis es causado por la liberación de ácido retinoico desde las células de Sertoli, y que el proceso continua con la liberación posterior por parte de las propias células germinales. El camino desde A1 hasta la entrada en meiosis es complejo pero coordinado e irreversible diferenciación en diferentes tipos de espermatogonias es por oleadas, provocado porque las citocinesis no son completas y las células de una cohorte comparten sus citoplasmas a través de puentes entre células. De manera que hay poblaciones de células que son clones que se dividen y diferencian coordinadamente.
En los tubos seminíferos de ratón, sólo un 17 % de la longitud del tubo se está dando la transición de A a A1, además de espermiogénesis (diferenciación de los espermatozoides). Además, distintos estados de diferenciación de las espermatogonias se suelen encontrar simultáneamente cuando se observa un segmento del tubo seminífero. Esto se debe a que el desarrollo de las células germinales se produce en oleadas temporalmente precisas y estas oleadas ocurren a diferentes tiempos a lo largo del túbulo seminífero, probablemente inducidas por la liberación de ácido retinoico desde las células de Sertoli, que lo hacen en determinados puntos del túbulo seminífero. Esto supone que hay una producción asíncrona de gametos, pero la posibilidad de una liberación continua de éstos. Este modelo de producción asíncrona está conservado en las mayoría de los mamíferos.
3. Nichos
Todas las células troncales adultas del organismo se encuentran en ambientes especiales de los tejidos denominados nichos. Son zonas del tejido con una composición química y celular característica que permite mantener la indiferenciación de las células troncales, pero además regulan su tasa de proliferación y entrada en diferenciación. Para el caso de las espermatogonias es muy difícil visualizar físicamente el nicho o lugar del túbulo seminífero donde se encuentra. El nicho de las espermatogonias se considera como un nicho abierto y no se puede limitar anatómicamente, incluso podría cambiar, crearse y desaparecer según las señales externas que reciba el testículo. Así, es probable que sólo se pueda encontrar mediante marcadores moleculares.
Parece ser que la formación y mantenimiento de un nicho de células indiferenciadas de espermatogonias requiere de la presencia de FGF (factor de crecimiento de los fibroblastos), que se libera por los vasos sanguíneo y linfáticos. Es por ello que las espermatogonias suelen estar próximas a zona donde hay vasos sanguíneos. Es interesante que los nichos que reciben más FGF llevan a favorecer la autorrenovación de espermatogonias A indiferenciadas respecto a la diferenciación. Otra característica de estos nichos es la presencia de GNDF (glial cell line-derived neurotrophic factor) liberado por las células somáticas del testículo, sobre todo por las endoteliales, y en menor medida por las células de Sertoli y otras células. GNDF es necesario para el establecimiento y mantenimiento del nicho. Los receptores para GNDF están presentes en las espermatogonias pero su número va disminuyendo a medida que las espermatogonias se van dividiendo, de modo que Aal16 ya no expresa el receptor.
Como se ha mencionado antes, es curioso que las As que expresan mucho ID4 (ver más arriba), o espermatogonias verdaderas, no se encuentran en estos nichos próximos a los vasos sanguíneos, luego esto indicaría que podría haber diferentes tipos de nichos. En cualquier caso, estas espermatogonias veraderas tendrían que trasladarse a estos nichos próximos a los vasos sanguíneos puesto que es ahí donde se desarrollan los clones.
El mantenimiento y funcionamiento de un nicho de espermatogonias depende además de muchos otros factores y células. Se han implicado a las células de Sertoli, células mioides peritubulares (los túbulos seminíferos están rodeados por músculo liso contráctil), macrófagos peritubulares, células endoteliales testiculares, células de Leydig, células endoteliales linfáticas, y las propias células germinales. Todas estas células contribuyen mediante la liberación de algún factor a el mantenimiento y proliferación de lés células germinales indiferenciadas. Quizá las células de Sertoli son las más importantes, pero las otras células son también necesarias. Por otra parte, no se han encontrado diferencias morfológicas entre las células de Sertoli que se encuentran en los nichos y aquellas que aparecen en oros lugares del tubo seminífero.
La vida en el embrión
Durante el desarrollo embrionario la formación de las células somáticas de los testículos y la formación de las espermatogonias ocurren de manera independiente. La expresión del gen Sry en el embrión de los machos produce la diferenciación de las células somáticas de los primordios gonadales (o crestas gonadales) en células de Sertoli, por tanto la gónada será un testículo. Su ausencia hace que se diferencien en células de la granulosa de los folículos ováricos, por tanto la gónada será un ovario.
Las células germinales primordiales se originan muy pronto durante el desarrollo embrionario. En los ratones aparecen en la capa embrionaria de epiblastos en el estadio E6, es decir, a los 6 días de desarrollo embrionario, mucho antes de que se formen los primordios gonadales. Después salen del embrión a una estructura denominada alantoides, y vuelven a entrar de nuevo en el embrión para invadir los primordios gonadales, ya formados, en el estadio E11. Unas 3000 células germinales primordiales colonizan las crestas gonadales de ratones macho. Allí interaccionan con las células de Sertoli ya diferenciadas, y esta interacción diferencia a su vez a las células de Leydig y mioides a partir de células intersticiales. Las células de Leydig e intersticiales son también células somáticas. Para E12.5 el testículo embrionario está formado y la determinación del sexo masculino culminada. En este punto, las células germinales primordiales y las células de Sertoli de mamíferos se organizan en cordones testiculares que se transformarán más tarde en túbulos seminíferos.
Las células germinales primordiales sufren inicialmente un periodo de amplificación por mitosis que incrementa su número enormemente. Tras esto tenemos ya a las denominadas preespermatogonias o gonadocitos, los cuales invaden los cordones testiculares formados por las células de Sertoli y células mioides. Las preespermatogonias entran en un estado de quietud hasta que se produce el nacimiento. Tras el nacimiento, las preespermatogonias, que se localizaban en el centro del túbulo seminífero, pasan a la periferia de éste y se convierten en espermatogonias troncales (As) dispuestas para entrar en meiosis, lo que ocurre durante la pubertad.
-
Bibliografía ↷
-
de Rooij DK. 2017. The nature and dynamics of spermatogonial stem cells. Development. 144. 3022-3030. doi:10.1242/dev.146571.
Griswold MD. 2016. Spermatogenesis: the commitment to meiosis. Physiological reviews. 96:1-17.
Mäkëla J-A, Hobbs RM. 2019. Molecular regulation of spermatogonial stem cell renewal and differentiation. Reproduction. 158: R169-R187
Phillips BT, Gassei K, Orwig KE. 2010. Spermatogonial stem cell regulation and spermatogenesis. Philosophical Transaction Royal Society B. 365: 1663–1678.
-