1. Morfología
2. Organización
- Filamentos delgados
- Filamentos gruesos
- Otras proteínas
- Costámeros
3. Contracción
4. Inervación
5. Tipos
Las células musculares esqueléticas estriadas forman los músculos de contracción voluntaria, los cuales normalmente están anclados a los huesos mediante los tendones, aunque también hay músculos voluntarios no asociados a huesos. Las células musculares esqueléticas son en realidad sincitios, es decir, un citoplasma rodeado por membrana que incluye a numerosos núcleos. Son células muy alargadas y se caracterizan por poseer un citoesqueleto muy desarrollado que permite el acortamiento de la longitud celular, lo que provoca la contracción muscular, y por ello el movimiento.
1. Morfología
Son células muy largas, de ahí el nombre de fibra muscular con el que también se les conoce, pudiendo ir desde varios milímetros hasta más de un metro de longitud. En un corte transversal pueden tener entre 10 y 100 µm de diámetro. Estas dimensiones se alcanzan gracias a la fusión de varios cientos de células musculares indiferenciadas denominadas mioblastos y a su posterior elongación. Las células musculares esqueléticas poseen muchos núcleos que se sitúan periféricamente en el citoplasma, justo debajo de la membrana plasmática, denominada sarcolema (Figuras 1 y 2). Los núcleos, inmediatamente tras la fusión de los mioblastos, se alinean en el interior de la nueva célula, se desplazan a la superficie y quedan ahí gracias a sus interacciones con el citoesqueleto. También otros orgánulos se mueven hacia la periferia celular. Esto deja la mayor parte del espacio intracelular para la maquinaria de contracción. La membrana plasmática de las células musculares esqueléticas presenta numerosas invaginaciones para formar los túbulos T. Los túbulos T se originan a nivel de las líneas Z (ver más abajo) y están implicados con la contracción muscular.


El contenido interno de la células musculares esqueléticas está dominado por el citoesqueleto, principalmente formado por filamentos de actina y de miosina II, esta última es una proteína motora. Ambas se asocian en haces denominados miofibrillas que se pueden observar como puntos cuando las células musculares se cortan transversalmente (Figura 2; ver también más abajo). Cada miofibrilla está rodeada por membranas del retículo endoplasmático liso, denominado específicamente como retículo sarcoplásmico (Figura 3). El retículo endoplásmico forma una red de túbulos rodeando a las miofibrillas que está íntimamente asociado a los túbulos T. Entre las miofibrillas también hay mitocondrias y cúmulos de glucógeno. Hay tres tipos de mitocondrias: intermiofibrilares, que está atrapadas por su unión a los filamentos intermedios de las líneas Z, perinucleares y subsarcolémicas que están unidas la membrana plasmática y a las miofibrillas de manera ligera. Los orgánulos que nos están entre las miofibrillas se concentran en el espacio que queda entre las miofibrillas y la membrana plasmática.

El nombre de célula muscular esquelética estriada se debe a que cuando se observa longitudinalmente con el microscopio óptico aparece un patrón de bandas claras y oscuras, a modo de estrías, dispuestas perpendicularmente al eje mayor de la célula (Figuras 1,2 y 4). Este bandeado es consecuencia de la superposición de los filamentos del citoesqueleto que forman las miofibrillas. Las bandas oscuras se denominan bandas A (por anisotropía, la cual se produce en la desviación de la luz cuando se observan con el microscopio de luz polarizada) y las claras bandas I (por isotropía en la desviación de la luz). En el interior de ambas bandas se pueden observar unas líneas divisorias denominadas discos Z y discos H, respectivamente. Los discos Z tienen forma típica de ziz-zag cuando se observan con el microscopio electrónico. Incluso el disco H tiene otra línea interna más oscura denominada línea M. La porción de miofibrilla comprendida entre dos discos Z se denomina sarcómero.

2. Organización molecular del citoesqueleto
Los sarcómeros de las células musculares esqueléticas estriadas son el resultado de la organización de una gran cantidad de proteínas con diferentes funciones (Figuras 4 y 5). Vamos a ver las más destacadas y algunas de sus funciones.

Filamentos delgados
Actina. Las moléculas de activa son el principal componente del filamento delgado del sarcómero. Cada filamento de actina está formado por dos hélices alfa enrolladas que están asociadas con las proteínas tropomiosinas y troponinas (Figura 6). Los filamentos maduros de actina miden aproximadamente 1 µm en longitud, la cual es extraordinariamente constante en las células musculares estriadas y se consigue por la participación de numerosas moléculas asociadas (ver más adelante). Existen diferentes isoformas de actina que, aunque muy parecidas estructuralmente, se expresan en tipos celulares y momentos del desarrollo diferentes. Dos de ellas se expresan específicamente en el músculo estriado, tanto cardiaco como esquelético, y otras dos también presentes en el músculo estriado se expresan además en otros tejidos.

Tropomiosina. Está formada por dos cadenas alfa helicoidales ensambladas como hileras y asociadas a los filamentos de actina. Hay muchas isoformas de tropomiosina derivadas por maduración selectiva de 4 genes. Las hileras de tropomiosina se extienden a lo largo de todo el filamento de actina y se localizan en los dos surcos que dejan dichos filamentos. Su principal papel, junto con la troponina, es regular la interacción entre los filamentos de actina y las cabezas de miosina. Su acción en el contracción muscular se debe a un cambio conformacional que permite o impide el contacto de las cabezas de miosina con los filamentos de actina. En el estado de relajación, la tropomiosina bloquea el contacto actina-miosina, pero el aumento de la concentración de calcio lo hace posible, y por tanto se produce la contracción muscular. Es interesante que la posición de la tropomiosina varía ligeramente dependiendo de las isoformas de actina y tropomiosina que se expresen en el músculo.
Troponina. Hay tres tipos de troponinas asociadas a los filamentos de actina, C, I y T, que forman un complejo que coopera con la tropomiosina para permitir o no la interacción entre filamentos de actina y miosina. Hay una expresión diferencial de isoformas de troponina, de manera que cada una modula la contracción muscular de forma distinta en diferentes tejidos. El papel de estas moléculas en el músculo estriado esquelético es menos conocido pero el 25 % de las cardiomiopatías hipertróficas se atribuyen a mutaciones en las troponinas.
CapZ y tropomodulina. Son moléculas que se unen a los extremos de los filamentos de actina controlando su elongación y acortamiento. CapZ se une al extremo más e influye en la nucleación y estabilización de los filamentos de actina. Es un heterodímero formado por unidades alfa y beta, que en el músculo estriado están embebidas en las líneas Z, donde se unen a la actina. La tropomodulina se une al extremo menos del filamento de actina, el extremo libre. Su capacidad de unirse y estabilizar el extremo menos de los filamentos de actina depende de su unión simultánea a la tropomiosina. El papel de la tropomodulina es fundamental para establecer la longitud y estabilidad de los filamentos de actina, lo cual determina las propiedades contráctiles de la célula muscular. Por ejemplo, las alteraciones de la tropomodulina provocan filamentos de actina más largos que llevan a ritmos de contracción mucho más lentos.
Filamentos gruesos
Miosina. El filamento grueso del sarcómero está formado por miosina y otras proteínas asociadas (Figura 7). Hay cientos de moléculas de miosina de la clase II en un filamento grueso. La molécula miosina posee una parte globular donde se encuentra la cabeza que genera el movimiento y una parte lineal que es la encargada de anclarse a otras miosinas y formar junto a ellas el filamento grueso. Existen varias isoformas de miosina que tienen ligeras diferencias en la zona globular y filamentosa que resultan en diferentes propiedades de contracción, y que se expresan de diferente forma según el tipo de músculo. Los extremos del filamento grueso se interdigitan y solapan con los filamentos de actina. Las cabezas globulares de la miosina forman los puentes con los filamentos de actina que permitirán el movimiento. Aparte de la miosina hay otras proteínas asociadas al filamento grueso entre las que se encuentran la titina, las proteínas C y H localizadas en la zona C, y la AMP-desaminasa.
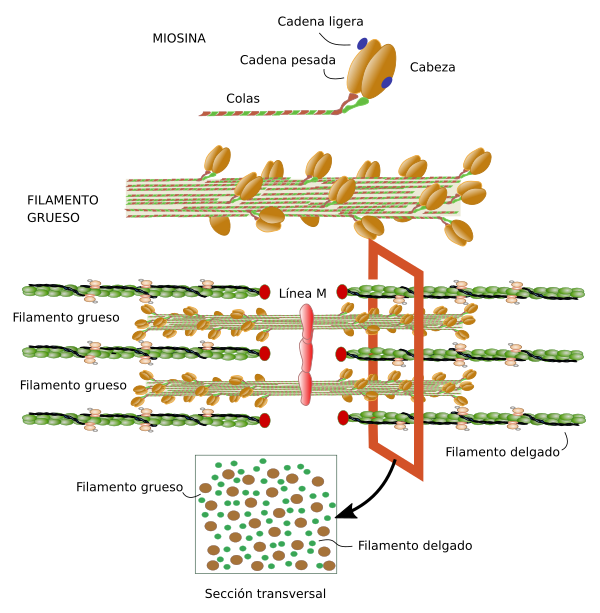
La línea M es la zona de anclaje de los filamentos gruesos. En ella se encuentran proteínas como la miomesina, la cual une miosina y titina, y que por ello podría ser un elemento estructural importante. También en la línea M está la proteína M, pero sólo en las células de contracción rápida y en las cardiacas. MURF-1 es otra proteína de la línea M que se une a la titina.
Otras proteínas
La titina se puede considerar como el tercer filamento de los sarcómeros. Tras la actina y la miosina, es la tercera proteína más abundante en el músculo y es la proteína más larga identificada hasta la fecha (38138 aminoácidos). Ancla su extremo N-terminal en la línea Z y el extremo C-terminal en la línea M. Tanto uno como otro extremos se solapan con los de otras titinas de sarcómeros adyacentes formando así un sistema continuo. Parte de la proteína, localizada en la banda I, tiene propiedades elásticas y parece contribuir a la resistencia al estiramiento de los sarcómeros, además de establecer una longitud máxima para el sarcómero.
La nebulina es otra proteína gigante, que va desde la línea Z hasta el extremo libre de los filamentos de actina. Es una molécula que no puede ser estirada y por ello se cree que controla la longitud exacta de los filamentos de actina, aunque también parece actuar en la regulación de la interacción entre filamentos de actina y de miosina. Curiosamente la nebulina no se ha detectado en el músculo cardiaco, aunque parece haber otras proteínas parecidas que hacen su función.
En torno a la línea Z hay muchos filamentos intermedios que probablemente colaboren en la conexión lateral de las miofibrillas. Aquí se encuentra la desmina, un filamento intermedio que también aparece asociado a los costámeros (ver más abajo), cuya misión es trabar los discos Z y establecer conexiones de estos discos con la membrana plasmática, núcleos, mitocondrias, y probablemente con los microtúbulos. También hay numeras proteínas que actúan como transductores de señales que pueden alternar su posición entre la línea Z y otras partes de la célula. Hay otras proteínas como la alfa-actinina, que establece enlaces entre los filamentos de actina, y la MLP, que ayuda a la integridad del sarcómero y comunicación con los núcleos de la célula. Otras son las proteínas FATZ, las miopaladinas, filamina, telotonina, etcétera.
Costámeros
Las miofibrillas de las células musculares deben anclarse a proteínas de la membrana plasmática. Los costámeros son agregados proteicos localizados en la membrana plasmática que sirven de punto de anclaje a las líneas Z y M. La célula muscular está rodeada por una matriz extracelular especial denominada lámina basal que aporta integridad estructural a la célula. Los costámeros son los intermediarios que anclan las miofibrillas a la lámina basal. Entre las proteínas que median la adhesión con la matriz extracelular están las integrinas, que además de adhesión actúan como sensores mecánicos. Una proteína central de los costámeros es la distrofina que se une a las lamininas de la lámina basal. Mutaciones en la distrofina producen distrofia muscular. La spectrina es otra proteína presente en los costámeros que ayuda en la conexión con el citoesqueleto.
Los filamentos intermedios son elementos del citoesqueleto que también ayudan a mantener la integridad de la células muscular y colaboran en la unión de las miofibrillas con la membrana plasmática. La plectina, por otra parte, es una molécula importante intermediaria entre las miofibrillas y los filamentos intermedios. Las anquirinas favorecen la asociación de los costámeros y la membrana plasmática, pero también ayudan a organizar las proteínas en la membrana como canales y bombas en dominios específicos de la superficie celular.
Hay proteínas asociadas a los sarcómeros que también se han encontrado en el interior del núcleo. Estas proteínas pueden cruzar la envuelta nuclear en los dos sentidos y se cree que son mensajeras que llevan a los núcleos información del estado de los sarcómeros.
3. Contracción
La función de los miocitos es la contracción y como resultado se produce el movimiento en los animales. Las células musculares se contraen por la acción de su citoesqueleto. La unidad de contracción se denomina sarcómero, que es la parte de la miofibrilla comprendida entre dos discos Z consecutivos. Esto es aproximadamente unos 4 µm en un músculo relajado. Durante la contracción los discos Z se pueden acercar hasta 1 µm de distancia. Esto ocurre por un acortamiento de la banda I, mientras que la A es de anchura fija. Ocurre porque los filamentos de actina son arrastrados sobre los de miosina II.
El acortamiento de la banda I se explica de la siguiente manera. Los filamentos gruesos están formados de manera que las cabezas de la miosina II, las cuales ejercen una fuerza tractora, se encuentran orientadas de forma antiparalela (Figura 7), de manera que en los dos extremos la fuerza tractora es hacia la zona media del filamento grueso. Lo que arrastran estas cabezas de miosina II son los filamentos de actina de las bandas I.
El proceso de la contracción muscular empieza con una despolarización de la membrana plasmática y termina con un desplazamiento de los filamentos de miosina sobre los de actina. Es lo que se conoce como el acoplamiento entre excitación y contracción. El mecanismo de contracción y relajación muscular depende del aumento y disminución, respectivamente, de la concentración de calcio libre en el citosol. Fue uno de los primeros descubrimientos cuando se estudió la contracción muscular, el calcio era el activador de la contracción muscular. También se descubrió que el calcio citosólico libre proviene del retículo endoplasmático, y que la bajada de calcio citosólico es porque vuelve a ser secuestrado en este orgánulo y por las mitocondrias. De manera que hay una comunicación rápida entre la excitación de la membrana plasmática y la liberación de calcio desde el retículo.
Los pasos serían los siguientes. 1) Despolarización de la membrana plasmática. 2) Propagación radial de tal despolarización a lo largo de los túbulos T. 3) Detección de la despolarización por los canales dependientes de voltage tipo L Cav1.1. 4) Interacción alostérica entre los canales de calcio Cav1.1 y los receptores de rianodina RyR1 de la membrana del retículo. Aquí es donde se produce el acoplamiento entre despolarización y la contracción. 5) Los canales RyR1 permiten la liberación de calcio desde el retículo endoplasmático y aumenta su concentración en el citosol. 6) Activación de los elementos del sarcómero y contracción celular. 7) Sistemas de amortiguación de la concentración de calcio y desaparición del calcio citoplasmático mediado por su incorporación en las mitocondrias, transporte por el intercambiador Na+/Ca2+ y su recaptación final por el retículo mediado por SERCA (smooth endoplasmic reticulum calcium adenosin).
Curiosamente, en las células musculares esqueléticas, al contrario que en las cardiacas, no se necesita una entrada masiva de calcio desde el exterior celular para activar la contracción de la célula.
4. Inervación
Los miocitos están inervados por neuronas denominadas neuronas motoras, o motoneuronas, localizadas en la médula espinal y en el tronco encefálico. Cada neurona es capaz de inervar a varios miocitos (una neurona más los miocitos inervados por ella constituyen lo que se llama unidad motora), pero cada miocito está inervado por una sola motoneurona. Los axones de las motoneuronas terminan sobre los miocitos formando una estructura denominada placa motora o unión neuromuscular. Es una sinapsis especial establecida por el terminal axónico y la membrana del miocito, todo ello cubierto por expansiones gliales de las células de Schwann. El neurotransmisor implicado en las placas motoras es la acetilcolina. También hay una inervación sensitiva que se compone de los receptores encapsulados y de los receptores tendinosos, los cuales llevan información sobre el estado de contracción y posición de las células musculares.
5. Tipos
Mediante técnicas histoquímicas se pueden detectar tres tipos de células musculares: rojas, claras e intermedias. Los tres tipos están presentes en todos los músculos pero su proporción varía según la función particular de dicho músculo. La diferencia entre ellos es la presencia de más o menos mioglobina, que es un proteína presente en el interior de la célula y con capacidad para transportar oxígeno. Así, las fibras rojas son células de pequeño tamaño con una gran concentración de mioglobina en su interior y con muchas mitocondrias, y esto les permite una contracción lenta y sostenida, por ejemplo en aquellas que permiten mantener la postura. Las fibras blancas poseen menos mioglobina y menos mitocondrias, y tienen un tamaño celular mayor. Son células con capacidad para una contracción rápida, pero se fatigan fácilmente. Estos músculos participan en los movimientos precisos y rápidos. Las fibras intermedias tienen propiedades mixtas.
-
Bibliografía ↷
-
Calderón JC, Bolaños P, Caputo C. 2014. The exitation-contraction coupling mechanism in skeletal muscle. Biophysical reviews. 6: 133-160. DOI 10.1007/s12551-013-0135-x.
Clark KA, McElhinny AS, Beckerle MC, Gregorio CC. 2002. Striated muscle cytoarchitecture: an intricate web of form and function. Annual review of cell and development biology. 18: 637-706.
-