El tejido adiposo es un tejido conjuntivo especializado en el almacenamiento de lípidos. Se puede considerar como un tejido conectivo un tanto atípico puesto que posee muy poca matriz extracelular, pero su origen embrionario son las células mesenquimáticas derivadas del mesodermo, las cuales dan también lugar al resto de tejidos conectivos. El tejido adiposo está presente en todos los mamíferos y en algunas especies de animales no mamíferos. Su capacidad para almacenar lípidos depende de sus células, los adipocitos, que pueden contener en su citoplasma grandes gotas de grasa. La grasa es un buen almacén de energía puesto que tiene aproximadamente el doble de densidad calórica que los azúcares o las proteínas. Los triacilgliceroles almacenados en el tejido adiposo son la principal fuente energética de los mamíferos. Estos almacenes se emplean para proporcionar moléculas energéticas a otros tejidos o para generar directamente calor. Los adipocitos se agrupan estrechamente y en gran número para formar el tejidos adiposo, aunque también se pueden encontrar dispersos en el tejido conectivo laxo. Tras el tejido adiposo, el hígado es la segunda estructura que más lípidos almacena en gotas de lípidos.
El tejido adiposo es celularmente complejo puesto que habitualmente sólo un tercio de sus células son adipocitos, mientras que el resto está formado por que se conocen conjuntamente como células del estroma y vasculares, que incluye a las células mesenquimáticas (células madre adultas), preadipocitos, fibroblastos, células endoteliales precursoras, pericitos, monocitos, macrófagos, además de las células de los vasos sanguíneos.
El tejido adiposo no sólo almacena energía, sino que también regula el metabolismo corporal general (energía global, sensibilidad a la insulina, ingesta de alimento), la presión sanguínea, angiogénesis, inflamación e inmunidad a través de la liberación de hormonas, citocinas, proteínas, lípidos específicos, y mi-ARNs. Hasta la mitad del siglo XX se pensaba que el tejido adiposo era metabólicamente inerte, y por ello no atrajo mayor interés.
Hay dos tipos principales de tejido adiposo: el formado por grasa blanca (o unilocular) cuyos adipocitos presentan una gran gota de lípidos y está sobre todo implicado en el almacenamiento de energía, y el formado por grasa parda (o multilocular), cuyos adipocitos presenta muchas gotas de grasa pequeñas y que está implicado sobre todo en termogénesis. El color blanco (a veces amarillento) o pardo se refiere al color de la grasa en su estado fresco. Ambos tipos de grasa tienen características particulares (Figura 1). Un tercer tejido adiposo sería el beige, que también produce calor, y que surge en el tejido adiposo blanco en ciertas estímulos, desaparecidos los cuales estas células también desaparecen.

El origen de los diferentes tipos de adipocitos quizá sea uno de sus aspectos menos conocidos. Aunque los dos tipos de grasa derivan de células mesenquimáticas, lo hacen a partir de poblaciones diferentes. De hecho, la grasa parda comparte progenitor con las células musculares, no así la blanca (Figura 2).

1. Grasa blanca
El tejido adiposo blanco o unilocular que forma la grasa blanca está presente en todos los mamíferos y es el tejido graso predominante. Las células que forman este tejido, los adipocitos, son células redondeadas muy grandes, de más de 100 µm de diámetro, que poseen una sola y gran gota de grasa, la cual ocupa prácticamente todo el citoplasma, de ahí el nombre de unilocular. Tanto el núcleo como el resto de los componentes citoplasmáticos ocupan un fino espacio periférico, próximo a la membrana plasmática (Figura 3), y no poseen muchas mitocondrias. Es frecuente observar en animales bien alimentados adipocitos que presentan numerosas gotas de grasa, dispersos entre otros que son claramente uniloculares (Figura 3). No hay que confundir estos adipocitos con los adipocitos multiloculares de la grasa parda puesto que durante su diferenciación los adipocitos uniloculares contienen múltiples gotas de grasa en su citoplasma, como se observa en la Figura 3. Todas esas gotitas de grasa se condensarán en una sola cuando el adipocito madure. Es decir, los adipocitos de la grasa blanca pueden pasar por un periodo multilocular durante su diferenciación. También, en mucha menor cantidad, se pueden observar adipocitos denominados beige, posiblemente derivados de los propios adipocitos blancos, con las mismas características que los adipocitos de grasa parda.
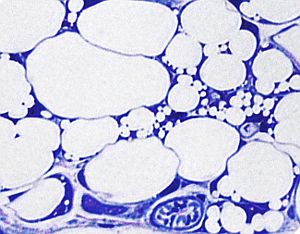
Los adipocitos están separados entre ellos por finas capas de tejido conectivo laxo formado sobre todo por fibras reticulares, que son secretadas por los propios adipocitos. Además, rodeando al adipocito, próxima a la membrana plasmática, hay una fina y característica capa de material extracelular denominada lámina externa, similar a la lámina basal de los epitelios. En las zonas del cuerpo del animal sometidas a estrés mecánico el tejido adiposo forma lóbulos, los cuales son grupos de adipocitos separados por láminas de tejido conectivo (Figura 4), denominadas septos, que pueden ser más o menos anchas dependiendo de la resistencia mecánica que deban soportar. En el tejido adiposo, entre los adipocitos y en las capas de conectivo, también se encuentran mastocitos, macrófagos, algunos fibroblastos, leucocitos y células precursoras de los adipocitos.
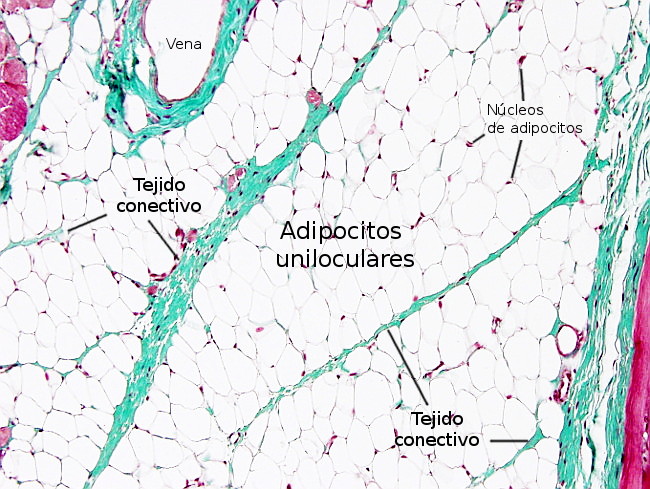
Por el tejido conectivo viajan los vasos sanguíneos y nervios, y pueden aparecer nódulos linfoides en las zonas mesentéricas. La irrigación sanguínea es muy densa en el tejido adiposo, tanto como la del músculo, y el endotelio de los capilares es de tipo continuo. La inervación nerviosa es dual: efectora por parte del sistema nervioso autónomo simpático y sensorial mediada por prolongaciones sensoriales pertenecientes a los ganglios espinales dorsales. Estas terminaciones nerviosas no suelen terminar sobre los adipocitos sino en torno a los vasos sanguíneos. Toda la inervación es simpática, y no hay inervación parasimpática.
El tejido adiposo unilocular se localiza en diferentes regiones del cuerpo de los mamíferos y sobre todo en dos regiones: la subcutánea y la visceral (Figura 5). La separación de estos dos grupos de depósitos de grasa se da ya durante el desarrollo embrionario tardío. Además hay depósitos dermales y en la médula ósea. En humanos existen zonas de alta acumulación de adipocitos (Figura 6) que suelen tener diferentes localizaciones en hombres y en mujeres. Parece además que los diferentes depósitos de grasa en el cuerpo tienen diferentes funciones. Hay evidencias que sugieren que es la distribución de la grasa blanca más que su cantidad general lo que indica el riesgo de patologías metabólicas. Por ejemplo, la acumulación de grasa en los depósitos viscerales y subcutáneos abdominales confieren un alto riesgo de diabetes tipo II y enfermedad cardiovascular. La que se acumula en la parte de los glúteos y femorales pueden ser protectoras. Internamente es abundante en los mesenterios e intraperitonealmente, y hay menos proporción en la médula ósea y otras regiones alrededor de los órganos.


El depósito subcutáneo (Figura 7), además de actuar como lugar de reserva, también funciona en algunas especies como capa aislante frente al frío. Asimismo, la grasa que se encuentran en la planta de los pies o en la palma de las manos tienen una función de protección mecánica más que reserva de energía. Hay un depósito dérmico que es diferente del subcutáneo y ambos están separados físicamente. El depósito dérmico está relacionado con la reparación de heridas, generación de los folículos pilosos y termogénesis. Hay dos subtipos de tejido adiposo en la médula ósea: constitutivo y regulado. Están relacionados con el fisiología del hueso (actividad de osteoclastos y mineralización) y pueden ser la principal fuente de adiponectina libre circulante.

Como se ha comentado, los diferentes depósitos de adipocitos, por ejemplo, el subcutáneo y el visceral, tienen diferentes efectos en la fisiología del cuerpo, lo que puede ser debido a que fenotípicamente los adipocitos de ambos depósitos son diferentes. Esto se ha demostrado estudiando los marcadores que expresan y su perfil de expresión génica. Es interesante que cuando se cultivan adipocitos de diferentes depósitos en el mismo medio de cultivo sigue existencia de tal diferencia en la expresión de genes durante muchas generaciones. Por otra parte, el origen de los adipocitos, o pre-adipocitos como paso previo a la obtención de adipocitos diferenciados, es diverso, incluso en aquellos que pertenecen al mismo depósito. Por ejemplo, se ha visto que células derivadas del mesotelio pueden dar pre-adipocitos del depósito visceral, y también hay pre-adipocitos provenientes de la pared de las arterias que irrigan el tejido adiposo, teniendo éstos últimos marcadores también de músculo liso. Otra fuente de pre-adipocitos es la médula ósea. Aunque la mayoría de los preadipocitos tiene origen mesodérmico, algunos pre-adipocitos parecen derivar de las crestas neuronales, al menos durante algunas etapas del desarrollo. Esto puede explicar que dentro de un mismo depósitos los adipocitos sean funcionalmente heterogéneos en su respuesta a la insulina, síntesis de triglicéridos, incorporación de ácidos grasos, etcétera.
El tejido adiposo es uno de los pocos tejidos que puede incrementar y disminuir su volumen de manera drástica en animales adultos. Esto es gracias a la capacidad de crecer en tamaño de los adipocitos, así como a la capacidad de proliferación de éstos a partir de células precursoras. Estas células precursoras se encuentran entre la fracción de tejido conectivo del tejido adiposo. En los atletas el tejido adiposo puede representar el 2 al 3 % del peso corporal, mientras que en las personas obesas puede llegar hasta el 60 o 70 %. Los valores considerados normales en humanos varían entre el 9 y el 18 % en varones y entre el 14 y el 28 % en mujeres. Se considera a una persona obesa cuando la proporción de tejido adiposo sobrepasa el 22 % en varones y el 32 % en mujeres. La capacidad de hipertrofia e hiperplasia varía entre los diferentes depósitos de grasa del cuerpo. Incluso entre el mismo depósito en hombres y mujeres.
El tejido adiposo tiene también una importante función autocrina, paracrina y endocrina mediante la producción de factores y moléculas denominadas en su conjunto adipocinas, que afectan a la sensibilidad a la insulina e influyen en la homeostasis del metabolismo. Por ejemplo, la leptina es una hormona adipocina que afecta a la ingesta de alimentos actuando sobre el sistema nervioso central. También producen otras como la resistina y la adiponectina. A su vez, el tejido adiposo está regulado por hormonas como la noradrenalina y los glucocorticoides, que favorecen la liberación de ácidos grasos de los adipocitos (lipólisis), y la insulina que provoca el almacenamiento de los triacilglicéridos (lipogénesis). Los adipocitos también almacenan vitaminas solubles en grasas.
En ratones, cuando aumenta el frío, se ha demostrado que en algunos depósitos de grasa como los inguinales puede haber una conversión de células de grasa blanca en células similares a las encontradas en la grasa parda, lo que hemos denominada grasa beige. Esto ocurre sin la necesidad de síntesis de adipocitos nuevos desde precursores, sino que es un proceso de transdiferenciación a partir de células diferenciadas. Estos adipocitos multiloculareas se denominan adipocitos "brite" o beige. Son capaces de expresar la proteína UCP1, la cual desacopla en las mitocondrias la producción de ATP, de manera que el gradiente de protones se emplea para producir calor. En animales de experimentación se ha demostrado que la activación de la conversión de grasa blanca en grasa beige es un tratamiento para prevenir la obesidad y la aterosclerosis, por lo que la estimulación de esta vía de transdiferenciación se está estudiando como una terapia para combatir la obesidad y aterosclerosis humana.
2. Grasa parda
La grasa parda está formada por adipocitos maduros que contienen, no una, sino numerosas gotas de lípidos. Así, las imágenes de microscopía óptica muestran estas células con numerosos huecos, debido a que durante el procesamiento histológico estándar se eliminan las sustancias grasas. Por ello también se llaman adipocitos multiloculares. La grasa parda es frecuente en los animales hibernantes y en los fetos y neonatos de mamíferos, mientras que en los adultos está muy reducida. Durante el desarrollo la grasa parda aparece antes que la blanca, puesto que se forma y se diferencia antes del nacimiento para proteger a los recién nacidos del frío.
Los adipocitos multiloculares son más pequeños que los uniloculares y su núcleo no suele estar aplanado sino redondeado y situado en cualquier parte del citoplasma. El color pardo de este tipo de grasa en fresco es debido a la presencia de multitud de mitocondrias en su citoplasma (el color rojizo lo da el grupo hemo del citocromo C presente en las mitocondrias), las cuales contienen una gran cantidad de citocromo oxidasa. También ayuda al color su alta vascularización. El tejido adiposo pardo está inervado por el sistema nervioso simpático. Estos adipocitos se caracterizan por poseer la proteína UCP1, también llamada termogenina, la cual desacopla la cadena de transporte de electrones de la síntesis de ATP, de manera que esa energía que genera la cadena de transporte de electrones en forma de gradiente de protones se emplea en la producción de calor. Cuando hace frío, los terminales nerviosos del sistema simpático liberan noradrenalina que es reconocida por los adipocitos pardos, lo que lleva a un proceso de lipólisis, liberación de ácidos grasos y activación de UCP1. UCP1 se encuentra en la membrana de las crestas mitocondriales y permite el paso de H+ a su través con lo que se desacopla el proceso de respiración y síntesis de ATP.
El aspecto de los adipocitos multiloculares puede cambiar según las condiciones ambientales, al menos en ratones. Se ha comprobado que en condiciones de temperatura alta o cálida, cundo no se necesita producir calor, y los animales están bien alimentados, los adipocitos de grasa parda se parecen a los de la grasa blanca. Cuando se someten después a bajas temperaturas revierten su aspecto a multiloculares y aumentan en número.
En humanos, la grasa parda aparece en adultos, pero su actividad decae con la edad y con ciertas patologías como la obesidad y diabetes. Se encuentra en regiones dispersas que se pueden agrupar en dos:
Viscerales: perivasculares (arterias aorta, carótidas, braquicefálicas, coronarias epicardiales, venas cardiacas, arteria mamilar interna, arterias y venas intercostales), en torno a órganos huecos (corazón, tráquea, bronquios mayores, mesocolon, omentum principal) y en torno a órganos sólidos (tórax paravertebral, páncreas, riñón, hígado, hilio del bazo).
Subcutánea: músculos anteriores del cuello, fosa supracavicular, bajo las clavículas, axila, pared abdominal anterior, fosa inguinal.

El tejido de grasa parda está dividido en lóbulos y lobulillos separados por tejido conectivo por el que viajan numerosos vasos sanguíneos, mucho más abundantes que en el adiposo blanco. Está inervado por el sistema simpático que tras la liberación de noradrenalina produce la estimulación que hace que los adipocitos pardos degraden lípidos y generen calor. Estas fibras nerviosas terminan sobre las propias células adiposas.
La grasa parda/beige también libera numerosas moléculas como metabolitos, péptidos, lípidos y micro RNAs. Como ejemplos tenemos a las prostaglandinas, adenosinas, endocannabinoides, y muchos otros.
-
Bibliografía ↷
-
Bibliografía
Frühbeck G, Sesma P, Burrell MA. 2009. PRDM16: the interconvertible adipo-myocyte switch. Trends in cell biology. 19: 141-146.
Gesta S, Tseng Y, Kahn CR. 2007. Developmental origin of fat: tracking obesity to its source. Cell. 131: 242-256.
Ghesmati Z, Rashid M, Fayezi S. Gieseler F, Alizadeh E, Darabi M. (2023). An update on the secretory functions of brown, white, and beige adipose tissue: Towards therapeutic applications. Reviews in endocrine and metabolic disorders. https://doi.org/10.1007/s11154-023-09850-0
Hausman DB, DiGirolamo M, Bartness TJ, Hausman GJ, Martin RJ. 2001. The biology of white adipocyte proliferation. Obesity review. 2: 239-254.
Luong Q, Huang J,Lee KY. 2019. Deciphering white adipose tissue heterogeneity. Biology. 8: 23
.
Rosenwall M, Wolfrum C. 2014. The origin and definition of brite versus white and classical brown adipocytes. Adipocyte. 3: 4-9.
Sanchez-Gurmaches J, Hung C-M, Guertin DA. 2016. Emerging complexities in adipocyte origins and identity. Trends in cell biology. 26:5
Sacks H, Symonds ME. 2013. Anatomical locations of human brown ddipose tissue. Functional relevance and implications in obesity and type 2 diabetes. Diabetes. 62:1783–1790
Saely CH, Geiger K, Drexel H. 2010. Brown versus white adipose tissue: a mini-review. Gerontology. 58: 15-23.
Sebo ZL, Rodeheffer MS. 2019. Assembling the adipose organ: adipocyte lineage segregation and adipogenesis in vivo. Development. 146 dev172098. doi:10.1242/dev.172098.
-
 Conectivo propio
Conectivo propio 