1. Tipos
2. Inducción
3. Funciones
- Homeostasis celular
- Deprivación alimentos
- Hipoxia
- Defensa
La autofagia es un proceso, presente en todas las células eucariotas, por el cual se digieren moléculas y orgánulos intracelulares en los lisosomas. La palabra autofagia fue acuñada por C. de Duve en 1963 y significa comida (fagia) propia (auto). El papel de la autofagia es múltiple. Existe un nivel basal de autofagia que actúa como mecanismo de control de calidad en la célula eliminando aquello que resulte defectuoso; es un mecanismo de ajuste del metabolismo celular al estatus nutricional de la célula. Así, participa en procesos naturales como en el metabolismo energético, reciclado de orgánulos, regulación del crecimiento, inicio del desarrollo embrionario, envejecimiento, etcétera. Pero además, la autofagia se activa también cuando hay algún tipo de estrés celular, infección por patógenos o malformaciones celulares internas. Todas estas vías convergen en una maquinaria molecular llamada genéricamente como genes relacionados con la autofagia. Más de 30 genes se han identificado en levaduras que están implicados en la autofagia, entre los que destacan los genes Atg.
1. Tipos
Aunque el término autofagia se utiliza normalmente para hablar de macroautofagia, hay que tener en cuenta que existen otros tipos de autofagia en las células (Figuras 1 y 2):
Macroautofagia. Proceso mediante el cual se engloban elementos citoplasmáticos en un compartimento delimitado por una doble membrana. Este compartimento resultante se denomina autofagosoma y se fusionará con un lisosoma donde se degrada su contenido, además de la membrana interna del autofagosoma.
Microautofagia. En este caso la membrana del lisosoma forma pequeñas invaginaciones que se desprenden de la membrana y quedan en el interior del lisosoma, donde son degradadas. En estas invaginaciones se incorpora material citosólico. La invaginación en los cuerpos multivesiculares se podría considerar como microautofagia.
Autofagia mediada por chaperonas. Mediante este proceso se incorporan proteínas citosólicas al lisosoma gracias a un transportador localizado en la membrana del lisosoma.
Crinofagia. Este proceso supone la fusión de vesículas destinadas a la exocitosis con el lisosoma.

2. Inducción
La autofagia se induce en una variedad de situaciones de estrés como la falta de alimento, la falta de factores de crecimiento, infecciones, estrés oxidativo o hipoxia. La autofagia se puede inducir experimentalmente, por ejemplo mediante la eliminación de aminoácidos de la dieta de la célula. También existe una autofagia basal y permanente en todas las células. Por tanto, la autofagia es necesaria para las células animales bajo cualquier circunstancia. Sin embargo, las plantas podrían vivir sin autofagia cuando están en condiciones favorables, y sólo se activaría en condiciones de estrés. En las plantas se activa bajo escasez de alimentos, calor o salinidad, pero también para otras funciones normales como envejecimiento de las hojas, mobilizar las reservas de almidón, germinación del polen, etc.
3. Proceso
El mecanismo mejor conocido es el de la macroautofagia. La macroautofagia puede ser selectiva o no selectiva. En la selectiva el material que se va englobar se marca primero y es reconocido por receptores de autofagia, incluyendo normalmente agregados de proteínas u orgánulos dañados o innecesarios (mitocondrias, retículo endoplasmático, cloroplastos, o incluso el núcleo bajo ciertas circustancias). En la no selectiva se engloba una parte del citoplasma de manera inespecífica, como por ejemplo durante periodos de deprivación de alimento.
La macroautofagia selectiva es un proceso molecular similar para la mayoría de las estructuras que se van seleccionar y a degradar (Figura 3). En las células animales el marcaje de la estructura es normalemente mediante ubiquitinación, es decir, la adición de la proteína ubiquitina como una especie de etiqueta. Posteriormente hay receptores que reconocen ese marcaje, los cuales interaccionan con proteínas ancladas a las membranas del fagóforo. En el caso de los orgánulos se ubiquitinan los dominios citosólicos de las proteínas ancladas a sus membranas, como es el caso de las peroxinas de los peroxisomas, o proteínas de la membrana externa de las mitocondrias. Sin embargo, el retículo no se selecciona por utiquitinación sino por proteínas específicas que se expresarán en sus membranas. En levaduras tampoco la eliminación de orgánulos se debe a ubiquitinación sino a la expresión de determinadas moléculas en sus superficies que son reconocidos por la maquinaria autofágica. Hay una autofagia selectiva que elimina patógenos intracelulares mediada también por ubiquitinación de alguna de sus proteínas.

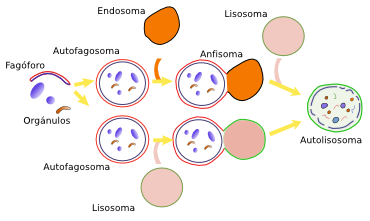
La macroautofagia no selectiva, pero probablemente también la selectiva, comienza con la activación de membranas celulares, las cuales pueden provenir del retículo endoplasmático, de zonas de contacto entre retículo y mitocondrias, del aparato de Golgi, y de la membrana plasmática. La activación se consigue con la síntesis de PIP3 de ciertas áreas de distintas membranas de la célula. Esta riqueza de PIP3 atraerá a diversas proteínas que provocaran la evaginación y desprendimientos de esas porciones de la membrana. Estas porciones formarán estructuras denominadas fagóforos o membranas de aislamiento. Las membranas del fagóforo engloban a las moléculas u orgánulos que van a ser degradados. Las membranas del fagóforo crecerá en extensión y terminará por unir sus extremos para formar un compartimento cerrado denominado autofagosoma, que posee doble membrana. El crecimiento tanto del fagóforo como del autofagosoma se produce por incoporación de nuevas porciones de membrana desde la membrana plasmática, desde el compartimento ERGIC, desde el aparato de Golgi (hay glúcidos con enlaces tipo O) y desde algunas vesículas. El autofagosoma se puede fusionar directamente con un lisosoma para formar el autofagolisosoma, donde se producirá la degradación de su contenido. El autofagosoma puede también recibir vesículas desde los endosomas o puede llegar a fusionarse directamente con ellos, tanto tempranos como tardíos. Los endosomas aportan proteínas lisosomales y bombas de protones, lo que va provocando la acidificación del fagosoma. Al compartimento resultante se le denomina anfisoma. Como último paso, el anfisoma se fusiona con los lisosomas permitiendo la degradación del contenido interno del autofagosoma junto con su membrana interna. Al compartimento que se crea tras la fusión también se le denomina autofagolisosoma. Cualquiera que sea el camino, la fusión del autofagosoma o anfisoma con los lisosomas se produce después de que a las membranas del autofagosoma o afisoma lleguen proteínas del tipo SNARE y rab que posibilitan el reconocimiento del lisosomas y fusión con él. En las plantas el autofagosoma se tiene que fusionar con la vacuola para degradar su contenido.
Cuando se produce una intensa autofagia tras un estrés celular el número de lisosomas disminuye enormemente. Durante la autofagia los lisosomas disminuyen en número tras 4 horas de privación de alimentos, pero crecen de nuevo a las 11 h. La población de lisosomas tiene que regenerarse de nuevo para que la célula vuelva a ser funcional. Se ha comprobado que se generan nuevos lisosomas por tubulación de las membranas de los autofagolisosomas. En la formación de estos túbulos participa el citoesqueleto y en sus extremos se generan vesículas mediadas por clatrina, que una vez liberadas se irán acidificando hasta convertirse en lisosomas maduros. Estas vesículas se llaman protolisosomas, porque madurarán a lisosomas funcionales. A este proceso se le llama regeneración de lisosomas (en inglés ALR: auphagic lysosome reformation).
4. Funciones
La autofagia en condiciones normales favorece el mantenimiento u homeostasis celular. El papel de la autofagia durante el estrés es favorecer la supervivencia de la célula, al menos a corto plazo. Lo que hace es degradar contenido intracelular de forma masiva con dos propósitos: disminuir el número de elementos que consumen energía y producir aminoácidos y otras moléculas para su uso en procesos esenciales. Sin embargo, la autofagia no es un proceso beneficioso a largo plazo, ya que si la situación de estrés se prolonga en el tiempo el proceso degradativo termina por deteriorar a la célula de manera irreversible. En realidad, lo que consigue es ganar tiempo durante una situación de estrés para que la célula o el organismo pueda contrarrestar dicho estrés.
Homeostasis celular
Se sabe que en ausencia de cualquier tipo de estrés celular existe un proceso basal de autofagia. Es, junto con los proteosomas, el principal mecanismo de degradar contenido celular. Mientras que la ruta ubiquitina-proteosma se especializa en degradar moléculas jóvenes, la autofagia se ha especializado en degradar moléculas que tienen una vida larga. Pero además es la única vía que degrada orgánulos completos tales como mitocondrias, peroxisomas o retículo endoplasmático. Existe un mecanismo no selectivo, que es basal y permanente, y otro selectivo que elimina estructuras dañadas. Este mecanismo selectivo actúa como control de calidad, asegurando a la célula un sistema de orgánulos en buen funcionamiento.
Algunas células a las cuales se les inhibe la autofagia se atrofian y mueren. En las plantas se ha demostrado también un nivel basal de autofagia, que cuando se inhibe provoca procesos de envejecimiento o senescencia acelerados, independientemente de las cantidades de nutrientes que añadamos. Es especialmente interesante destacar que la autofagia está alterada en enfermedades neurodegenerativas. Determinadas funciones tisulares, como la producción de surfactantes en pneumocitos II, neuromelanina en células dopaminérgicas, o la maduración de los eritrocitos dependen de la actividad autofágica. En las células musculares la autofagia tiene la misión de eliminar las mitocondrias defectuosas. La autofagia a veces lleva a la muerte celular como ocurre con las células mamarias, tras la lactancia.
Deprivación de alimentos
La falta de alimentos provoca en los ratones de experimentación que todos los tejidos experimenten un aumento de la autofagia, excepto el tejido nervioso. Los ratones que no tienen los genes para llevar a cabo la autofagia mueren tras el nacimiento, probablemente por el periodo sin alimento que tienen que soportar en ese momento, y por no poder realizar autofagia basal. La autofagia desencadenada por hambre es no selectiva en cuanto a la material que se va a degradar. Hay un mecanismo molecular que parece ser responsable de esta respuesta celular. mTORC1 (target of rapamycin 1) es una quinasa de serina/treonina que responde a niveles energéticos y de nutrientes de la célula y regula el crecimiento y la división celulares. mTORC1 favorece el catabolismo (degradación) o anabolismo (síntesis) en función de las condiciones en las que se encuentre la célula. Si la cantidad de aminoácidos es grande, lo que indica abundancia de nutrientes, mTORC1 se activa e inhibe los factores de transcripción que provocan la expresión de los genes que inician la autofagia. Si la cantidad de aminoácidos es baja, mTORC1 se inhibe y los factores de transcripción entran en el núcleo, y activan la expresión de los genes que inician la autofagia. Cuando la cantidad de nutrientes es alta mTORC1 se localiza en las membranas de los lisosomas donde es capaz de sentir los niveles de aminoácidos internos del lisosoma. Si esta concentración es vuelve baja, mTORC1 se despega de los lisosomas y se inactiva. La inactivación de mTORC1, además de activar la expresión de los genes de la autofagia, provoca el desplazamiento de los lisosomas hacia la zona interna de la célula donde se fusionan con los autofagosomas. Curiosamente, tras unas horas de autofagia, y restablecidos los niveles intracelulares de aminoácidos, mTORC1 se vuelve a activar y favorece la regeneración de los lisosomas a partir de los autofagolisomas mediante tubulación de éstos y emisión de vesículas que serán inicialmente prolisosomas que madurarán posteriormente a lisosomas.
Hipoxia
Durante una hipoxia cardiaca hay primero un corte en la circulación que conlleva un periodo de falta de suministro de oxígeno y nutrientes, seguido por un proceso de recirculación donde la sangre vuelve a fluir. Durante la isquemia o hipoxia, se dispara la macroautofagia debido a la falta de alimento y de oxígeno, lo cual tiene un carácter protector frente a la muerte celular.
Defensa frente a patógenos
La macroautofagia es uno de los sistema de defensa celular más antiguos y es la primera línea de defensa frente a infecciones por protozoos, bacterias y virus. A la degradación de células extrañas por autofagia se le denomina xenofagia. En las respuestas contra patógenos la macroautofagia actúa a diferentes niveles: eliminando los patógenos que han entrado en la célula, activando la información a las células del sistema inmune que facilitan la degración de los patógenos detectados, y el procesamiento y exposición de antígenos en superficie. Las células tienen unas proteínas denominadas TLRs (Toll-like receptors) localizados en las membranas de los endosomas que son capaces de reconocer ácidos nucléicos de los patógenos que han entrado en la célula. Este reconocimiento disocia el complejo formado por las proteínas BCL2/Beclin1, lo cual provoca el inicio de la autofagia. Entonces se marcan los patógenos con ubiquitina para su eliminación. Curiosamente algunos virus han desarrollado mecanismos para proliferar en los autofagosomas y aprovechar la producción de energía se que se consigue en ellos.
Bibliografía
Choi Y, Bowman JW, Jung JU. 2018. Autophagy during viral infection — a double-edged sword. Nature reviews in microbiology. doi: 10.1038/s41579-018-0003-6.
Eskelinen G-L. 2008. New insights into the mechanisms of macroautophagy in mammalian cells. Internacional review of cell and mollecular biology. 266:207-247.
Gatica D, Lahiri V, Klionsky DJ. 2018. Cargo recognition and degradation by selective autophagy. Nature cell biology 20:233-242.
Klionsky DJ. 2007. Autophagy: from phenomenology to molecular understanding in less than a decade. Nature reviews in molecular and cell biology. doi:10.1038/nrm2245.
Liu Y,Bassham DC. 2012. Autophagy: pathways for self-eating in plant cells. Annual review of plan biology. 63:215-237
Murrow L, Debnath J. 2013. Autophagy as a stress-response and quality-control mechanism: implications for cell injury and human disease.Annual review of pathology. 8:105-137
