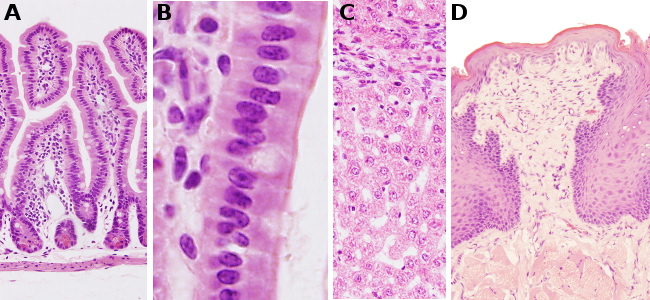
La mayoría de las células y matrices extracelulares no poseen un color propio por lo que su observación directa al microscopio óptico no permite observar sus características morfológicas. Para poder observarlos se emplean colorantes, sustancias dotadas de color que se unen de manera más o menos específica a determinadas estructuras del tejido.
Las tinciones generales se usan habitualmente en los laboratorios de histología para obtener una visión general de las muestras de tejido. Normalmente combinan más de un colorante. La tinción más común es la que combina una sustancia como la hematoxilina y el colorante ácido eosina.
Procedimiento
Partimos de muestras que han sido fijadas e incluidas en parafina. Estas muestras se han cortado en secciones de unas 8 µm de grosor y adheridas a portaobjetos recubiertos con gelatina-alumbre.
1.- 2x10 min en xileno para desparafinar
2.- 2x10 min en etanol 100º
3.- 10 min en etanol 96º
4.- 10 min en etanol 80º
5.- 10 min en etanol 50º
6.- 5 min en H2O destilada
7.- 5-10 min en Hematoxilina de Mayer
La hematoxilina no es un colorante en sentido estricto
sino que es la hemateína, su producto oxidado, la que teñirá
sustancias como la cromatina del núcleo y las grandes agregaciones ribosomales del
citoplasma, como las que se dan en el retículo endoplasmático rugoso.
8.- 15 min en agua corriente. Diferenciación.
9.- 2x1 min en H2O destilada
10.- 0.5 a 2 min en Eosina al 0.2 % en H2O
La eosina, colorante ácido, se une a elementos del citoplasma y de la matriz extracelular.
Se pueden usar tres tipos de eosina: eosina amarillenta (CI 45380), eosina azulada (CI 45400) y eosina soluble en alcohol (CI
45386). La primera es la más usada.
11.- Tiempo variable (unos cuantos segundos) en 70º para diferenciación
El tiempo de diferenciación depende de la intensidad de tinción de eosina que queramos en nuestra muestra. Se le pueden añadir unas gotas de ácido acético.
12.- 20s en etanol 96º
13.- 2x3 min en etanol 100º
14.- 2x10 min en xileno
15.- Montado con medio de montaje
Resultados
Colágeno: rosa pálido.
Músculo: rosa fuerte.
Queratina: rojo intenso.
Citoplasma: rosado.
Núcleos: azul oscuro o púrpura (en realidad se tiñe sólo la cromatina).
Eritrocitos: color cereza.
Consejos
Los fijadores ácidos dan mejores resultados para la eosina, mientras que los fijadores que contienen ácido pícrico favorecen una mejor tinción general. Los procesos de descalcificación usand ácidos fuertes provocan una pobre tinción nuclear.
La eosina es muy soluble en agua. Una tinción excesiva se puede disminuir con lavados prolongados en agua.
Aunque la hematoxilina de Mayer es comúnmente usada, se pude cambiar por otros tipos de hematoxilina (ver recetas).
Productos
Xileno
Etanol de 50º, 70º, 80º, 96º y 100º
Hematoxilina de Mayer
Eosina amarilla
H2O destilada
H2O corriente
Medio de montaje
Material
Cubetas de tinción
Cesta para portas
Cubreobjetos