El cambio de estado de la cromatina durante el ciclo celular es dramático. En la interfase una gran parte tiene una organización laxa y desempaquetada (eucromatina), aunque otra parte está condensada (heterocromatina). Durante el funcionamiento normal de la célula hay porciones de cromatina que alternan entre los estados laxo y condensado. Estas transiciones en el grado de organización del ADN son imprescindibles para el funcionamiento celular. Durante este periodo tienen que transcribirse (leerse) una gran cantidad de genes y por tanto ser accesibles a las polimerasas y factores de transcripción, por lo que la cromatina ha de estar descondensada. Sin embargo, durante la mitosis la cromatina alcanza un alto grado de compactación y organización para formar los cromosomas. En esta etapa del ciclo celular lo que prima es el reparto y la segregación del ADN entre las células hijas, lo que se hace mejor si la cromatina está bien empaquetada y dividida en porciones discretas, los cromosomas. Empaquetar la cromatina en cromosomas discretos para su posterior separación en mitosis se lleva a cabo, además de por las histonas, por un grupo de proteínas denominadas SMC (structural maintenance chromosome). Éstas son las cohesinas y las condensinas.
1. Cohesinas

La primera función que fue atribuida a las cohesinas (Figura 1), y por la cual llevan su nombre, es la de mantener las cromátidas hermanas unidas durante el ciclo celular hasta su correcta segregación en la anafase. En la levadura Saccharomyces cerevisae se ha comprobado que los complejos de cohesina se ensamblan a las cromátidas en las fases G1 y S del ciclo celular, al tiempo que éstas se replican. Este proceso se conoce como "carga" y es dependiente de ATP.
Durante la mitosis es esencial en primer lugar la ordenación de los cromosomas en la placa metafásica y en segundo lugar la pérdida de cohesión entre cromátidas hermanas que permita la migración a polos opuestos durante la anafase. Este proceso es posible por la liberación de forma abrupta de las cohesinas que dejan de enlazar a las cromátidas hermanas. Proceso que ha de coordinarse de forma estricta con el cambio de metafase a anafase, es decir, con la puesta en marcha de los mecanismos de tracción de los microtúbulos del huso mitótico. La acción simultánea de la separación de cromátidas y la tracción de los microtúbulos es el resultado de un mecanismo de convergencia entre dos vías moleculares que se inician antes en el tiempo y que están disparadas por la enzima quinasa dependiente de ciclina M (M-cdk).
Al llegar a la fase M la cohesina une cromátidas hermanas en toda su extensión (Figura 2), pero la M-cdk, entre los estados de profase y prometafase, fosforila directamente a un componente del complejo de la cohesina denominado kleisina (ver esquema molecular de la cohesina), lo que provoca la disociación de la cohesina de los brazos de las cromátidas pero no de los centrómeros, por lo que las cromátidas permanecen unidas por este punto. Las cohesinas del centrómero evaden esta fosforilación por la actividad de una proteína fosfatasa PP2A que se encuentra asociada a esta región. De este modo, las cromátidas hermanas enlazadas por el centrómero pueden disponerse de forma ordenada en la placa metafásica.
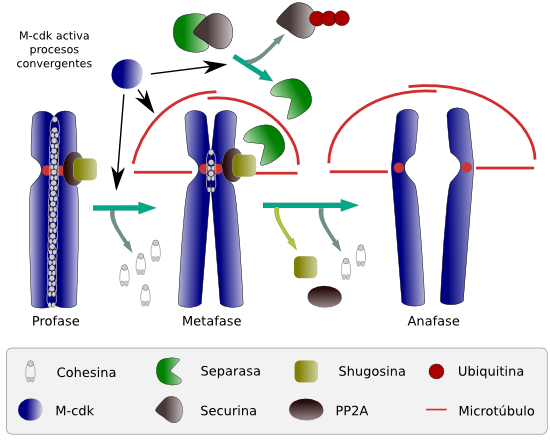
La M-cdk también ha fosforilado en las primeras etapas de la mitosis el complejo proteico APC (factor promotor de la anafase; en inglés: anaphase promoting factor), el cual disociará el dímero proteico securina-separasa. La misma M-cdk se ha encargado de fosforilar a proteínas que hacen que el citoesqueleto del huso mitótico cree las fuerzas que arrastrarán y separarán las cromátidas, ya desunidas. Estas fuerzas se manifiestan durante durante toda la mitosis.
Las cohesinas son también esenciales en el reparto de cromosomas durante la meiosis, pero aquí su actuación es más compleja que en la mitosis debido a que los procesos de segregación de los cromosomas son también más complejos. En la primera división meiótica los complejos de cohesina se disponen entrelazando tanto a las cromátidas hermanas (en los brazos y en el centrómero), al igual que ocurría en la mitosis, como a los brazos de los cromosomas homólogos, manteniendo así la cohesión de los bivalentes. De esta manera pueden permanecer unidos hasta su adecuada ordenación en el plano ecuatorial en la metafase I. Al comienzo de la anafase I, a través de la vía dependiente de separasa, se desligan los complejos de cohesina presentes en los brazos cromosómicos, los que enlazan cromátidas hermanas y los que unen cromosomas homólogos. De nuevo las cohesinas de la región centromérica conservan la unión existente entre cromátidas hermanas. Cada homólogo, con su par de cromátidas, migra a polos opuestos. Así concluye la primera división meiótica. Alcanzada la segunda división meiótica, en la prometafase II, los cinetocoros hermanos se asocian a los microtúbulos de polos opuestos celulares, aún con las cohesinas dispuestas en la región del centrómero. En la prometafase II tardía de mamíferos, la interacción de los microtúbulos de polos opuestos con los cinetocoros hermanos genera tensión en el centrómero desencadenando la deslocalización de la fosfatasa PP2A de los centrómeros y en la transición metafase II/anafase II, la separasa puede romper las uniones de las cohesinas centroméricas provocando la segregación de las cromátidas, al igual que ocurría en la mitosis.
Al margen de su función de cohesión entre cromátidas hermanas a lo largo del ciclo celular, a las cohesinas se les han atribuido también papeles en la reparación de ADN, en el control de la expresión génica y en otros nuevos roles que están siendo descubiertos en procesos bioquímicos ajenos a los aquí descritos.
Condensinas
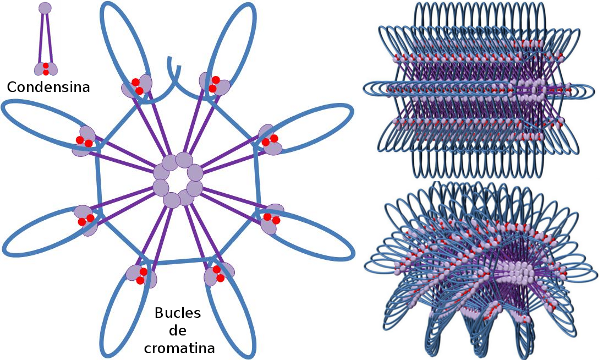
La condensación cromosómica resulta esencial por dos motivos. La primera es compactar la cromatina para formar los cromosomas y permitir así formar una estructura robusta que permita soportar el estrés de tracción al que se ven sometidos durante la segregación cromosómica. Por otra parte, sería difícil pensar en una segregación correcta del ADN entre las células hijas si la cromatina estuviese descondensada por todo el núcleo, se darían enrollamientos entre hebras de cromatina que impedirían su reparto. En esta compactación participan las condensinas (Fgiura 3).
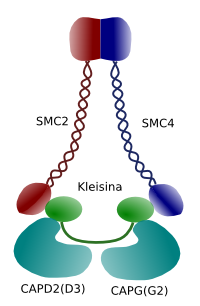
Se ha demostrado in vitro que el complejo SMC (ver el esquema del complejo molecular de la condensina) induce la tensión del DNA en un proceso dependiente de ATP. Primeramente, y en presencia de la enzima topoisomerasa I, induce el superenrollamiento de la cromatina. En segundo lugar, promueve la formación de lazos, en colaboración con la enzima topoisomerasa II. Se cree que los mismos procesos ocurren en las células durante la profase.
Las condensinas tienen dos funciones: una dependiente de ATP para enrollar dobles hélices cercanas de DNA, y otra independiente que ayudaría en la re-hibridación de las dos cadenas. El ATP parece esencial para la carga de la condensina en la cromatina, mientras que la hidrólisis afecta a la correcta localización y la formación de organizaciones más complejas de la cromatina.
Se cree que el dímero de subunidades SMC de la condensina puede aumentar el ángulo de apertura de sus brazos y asociarse a regiones distantes de las moléculas de DNA por interacción de éstas con los dominios de sus cabezas. A continuación, la estructura del dímero regresa a su estado inicial, induciendo una fuerza de tracción en el DNA que promueve su plegamiento formando un lazo (Figura 4). Mediante interacciones entre los dímeros SMC de distintos complejos de condensinas se formarían estructuras nucleoproteicas de mayor orden en disposición de anillos o hélices. Todo ello permite la condensación de la cromatina resultando en los cromosomas mitóticos.
Todos los organismos tienen algún tipo de condensina, incluidas las bacterias. Los hongos sólo tienen condensina I, sin embargo las algas tienen dos. Los hongos perdieron una. C elegans tiene tres condensinas. Los animales y las plantas tienen dos condensinas: I y II. La proporción de condensina I respecto a la II es aproximadamente 1 en la línea celular humana HeLa, pero 5 a 1 en Xenopus, y 10 a 1 en pollos.
Las condensinas I y II actúan en diferentes etapas del proceso de compactación de los cromosomas. La condensina I se concentra en los cromosomas en profase y desaparece de ellos en telofase. Está en el citoplasma durane la interfase, aunque puede persistir un conjunto de ellas en G1, que luego desaparece. La II se asocia a la cromatina en interfase y se concentra en los cromosomas en profase. Su función en interfase no está clara pero podría influir en la organización de la cromitina. La condensina II participaría en una fase temprana de condensación cromosómica, mientras que la condensina I, ayudada por la condensina II, será la que da forma y estabiliza los cromosomas en una fase de condensación más tardía.
La distribución espacial y temporal desigual determina el momento de acceso de las condensinas al material genético. Así, la condensación inicial de la cromatina durante la profase se produce por la actividad de la condensina II, gracias a que es fosforilada por diferentes quinasas. Al final de la profase la envuelta nuclear se desorganiza y la condensina I, que se encontraba en el citoplasma, tiene acceso a la cromatina. Entonces las actividades conjuntas de las condensinas I y II ayudan a compactar el ADN hasta los niveles vistos en los cromosomas metafásicos (Figura 5).

Las condensinas no se unen aleatoriamente al cromosoma. Tienen preferencias por centrómeros, telómeros, genes, y a regiones de comienzo y finalización de la transcripción, luego puede que su función se más que meramente estructural. Además, la condensina I se une específicamente a la histona H2A y H4 durante la mitosis.
A pesar de que los cromosomas de vertebrados son capaces de compactarse casi espontáneamente, en ausencia de condensinas pierden su arquitectura organizada durante la anafase. Además, se supone que los complejos de condensina deben permanecer activos tras el cese de la actividad Cdk a medida que transcurre la anafase, con el fin de garantizar la correcta migración de los cromosomas a los polos opuestos. La actuación de las condensinas en la compactación meiótica de la cromatina todavía no ha sido estudiada con detalle, por lo que no podemos aportar datos en lo que atañe a este mecanismo.
Los papeles de la condensina II se intuyen por mutantes que carecen de ella: se pierde condensación axial con cromomas más largos y curvados, las cromátidas parece más enredadas, también en anafase. También hay una profase más corta. Cuando falta la condensina I se produce sin embargo una falta en la condensación lateral, falla la citocinesis y las células se vuelven poliploides.
Las condensinas también se han relacionado con la regulación de la compactación de la cromatina durante la interfase. Al alterar el grado de compactación de la cromatina permiten o deniegan el acceso de la maquinaria de transcripción a las regiones génicas. Pero parece que este mecanismo regulatorio está basado en otras rutas moleculares distintas a las que actúan durante la mitosis, aunque también participen las condensinas.
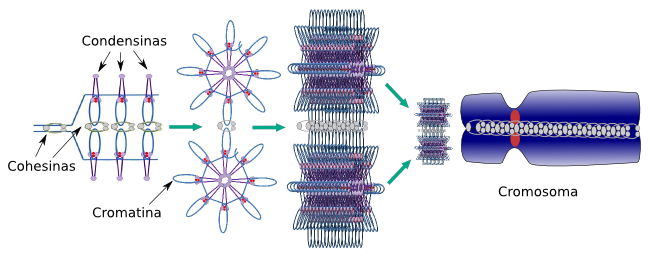
Se ha descrito la acción de las condensinas y de las cohesinas por separado pero ambas actúan conjuntamente y de forma coordinada durante la división celular. En el siguiente esquema se resumen ambas actuaciones (Figura 6).
Bibliografía específica
Barbero JL. 2009. Cohesins: chromatin architects in chromosome segregation, control of gene expression and much more. Cellular and molecular life sciences. 66:2025-2035.
Hirano T. 2005. SMC proteins and chromosome mechanics: from bacteria to humans. Phylosophical transactions of the Royal Society B. 360:507-514
Hudson DF, Marshall KM, Earnshaw WC. 2009. Condensin: Architect of mitotic chromosomes. Chromosome Research. 17:131-144
Kalitsis P, Zhang T, Marshall KM, Nielsen GF, Hudson DF. 2017. Condensin, master organizer of the genome. Chromosome research. 25:61-76
Maeshima K, Eltsov M. 2008. Packaging the genome: the structure of mitotic chromosomes. Journal of biochemistry. 143:145-53.
Nashmyth K, Haering CH. 2005. The structure and function of SMC and kleisin complexes. Annual Review of Biochemistry. 74:595-648
Ono T, Fang Y, Spector DL, Hirano T. 2004. Spatial and temporal regulation of Condensins I and II in mitotic chromosome assembly in human cells. Molecular biology of the cell. 15:3296-3308
Peters JM. 2008. The cohesin complex and its roles in chromosome biology. Genes and sevelopment. 22: 3089-3114
Uhlmann F, Lottspelch F, Nasmyth K. 1999. Sister chromatid separation at anaphase onset is promoted by cleavage of the cohesin subunit Scc1. Nature. 400, 6739:37-42
