1. Colorantes
2. Hematoxilina-eosina
3. Semifinos
4. Fluorescencia
5. Microscopía electrónica
La mayoría de los tejidos, sobre todo los de los animales, son incoloros y por ello necesitamos teñirlos para observar sus características morfológicas con el microscopio óptico. Ello se consigue con el uso de los colorantes, sustancias coloreadas que son capaces de unirse de manera más o menos específica a estructuras del tejido aportándoles color. Estas tinciones se realizan habitualmente sobre secciones de tejido, siendo las más utilizadas las secciones obtenidas a partir de inclusiones en parafina u obtenidas en el criostato.
1. Colorantes
La molécula de un colorante tiene normalmente dos componentes importantes: uno que aporta el color, denominado cromógeno, y otro que posibilita la unión a elementos del tejido denominado auxocromo. El cromóforo es la organización molecular dentro del cromógeno responsable de la absorción de un espectro determinado de longitudes de onda. El auxocromo que se une al cromógeno puede influir en su coloración y muchos colorantes tienen más de un grupo auxocrómico. El auxocromo puede ser un grupo ionizable, un grupo que reacciona químicamente con iones metálicos (mordientes) o puede reaccionar químicamente con el sustrato, en este caso el tejido. Los colorantes son normalmente hidrosolubles, aunque hay colorantes que carecen de grupos ionizables y sirven para teñir sustancias grasas, como gotas de lípidos.
Según la naturaleza química del cromóforo hay varios tipos de colorantes: nitrosos, ozoicos, derivados de la antroquinona, derivados de la acridina, derivados de iminas quinónicas, derivados de diferrilmetano y triferrilmetano, derivados del xanteno y derivados de las talocianinas.
Según la naturaleza química del radical auxocromo los colorantes se clasifican en:
Básicos: son sales en las que la base, normalmente una amina, aporta el color, mientras que la parte ácida es incolora. Es decir, son colorantes catiónicos. Tienen apetencia por sustancias ácidas del tejido como el ADN o ciertos componentes de la matriz extracelular como los glicosaminoglicanos. La unión es por atracción eléctrica. Así, ponen de manifiesto el núcleo y el ARN, sobre todo el ARN ribosómico presente en los ribosomas por ser muy abundante, así como ciertas matrices extracelulares ricas en componentes ácidos. Ejemplos de colorantes básicos son la tionina, safranina, azul de toluidina, el azul de metileno o la hematoxilina.
Ácidos: son sales con el anión coloreado y la base incolora. Son derivados de grupos sulfónicos, carboxilos o hidroxilos fenólicos. Tienen apetencia por sustancias básicas, sobre todo estructuras proteicas localizadas en el citoplasma celular y también por el colágeno de la matriz extracelular. La unión es por atracción eléctrica. Ejemplos de colorantes ácidos son la fucsina ácida, verde rápido, naranja G o la eosina.
Colorantes mordientes: son aquellos que se usan en combinación con sales metálicas, que actúan como mordiente. Estas sales se pueden emplear junto con el colorante, antes o después. En algunos casos el colorante mordiente puede ser también aniónico o, menos frecuentemente, catiónico. Normalmente se emplean para teñir los núcleos. Por ejemplo, la hematoxilina férrica de Heidenhain.
Neutros: poseen una porción ácida y otra básica, ambas con capacidad para aportar color. Por tanto un mismo colorante puede teñir tanto las partes básicas como las ácidas de los tejidos. Por ejemplo, el eosinato de azul de metileno.
Indiferentes o hidrofóbicos: realmente no se unen a elementos de los tejidos por afinidad química sino porque se disuelven en ellos. Por ejemplo, el colorante Sudán se disuelve en los lípidos y por tanto teñirá a las gotas de lípidos, especialmente en los adipocitos.
Los colorantes usados en histología se emplean a muy altas concentraciones y la cantidad que se une al tejido es realmente pequeña. Por eso, una solución de colorantes se puede usar muchas veces sin que se agote. La manera en cómo se consigue una tinción adecuada se puede dividir en dos tipos: progresiva y regresiva. La tinción progresiva consiste en obtener una coloración adecuada controlando el tiempo de la sección en el colorante, de modo que a más tiempo más coloración. La tinción regresiva consiste en la eliminación lenta de colorante de una tinción que ha sido teñida en exceso. Esta eliminación se consigue normalmente con soluciones alcohólicas y al proceso se le denomina desteñido. La concentración de la solución y tiempo de diferenciación nos aporta la coloración adecuada.
En algunas ocasiones necesitamos resaltar elementos tisulares de manera específica y para ello usamos colorantes que tienen apetencia por dichas estructuras. Por ejemplo, la tinción denominada azán contiene azocarmín y naranja-anilina-ácido acético que tiñen los núcleos de rojo y sobre todo destaca el conectivo intensamente teñido de azul. Otra tinción combinada es el tricrómio de Mallory que tiñe el colágeno de verde y las células musculares de rojo.
Cuando un colorante se une al tejido y aporta un color diferente al que tiene en solución se dice que ha ocurrido un fenómeno de metacromasia. Esto se debe a que las propiedades de absorción de la luz del colorante cambian al unirse a componentes celulares. Por ejemplo, el azul de toluidina se vuelve púrpura cuando se une a ciertos gránulos de los mastocitos. Cuando el colorante unido al tejido tiene el mismo color que en solución se denomina ortocromasia.
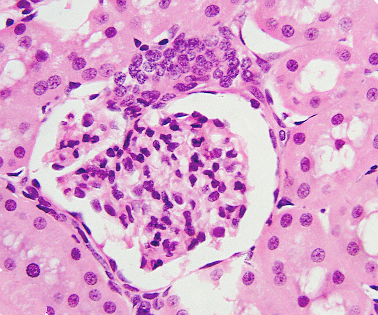
2. Hematoxilina-eosina
Una de las tinciones más comúnmente usada en histología es la hematoxilina-eosina sobre cortes de parafina (Figuras 1 y 2). Como vemos se usa un colorante básico (hematoxilina) y otro ácido (eosina) para teñir de diferente color a las estructuras ácidas y básicas de la célula. Antes de proceder a la tinción, si partimos de cortes de parafina, tenemos que llevar a cabo unos tratamientos previos sobre las secciones como es el desparafinado y la hidratación, puesto que estos colorantes son hidrosolubles. Si partimos de cortes de criostato esto no es necesario.

3. Semifinos
Cuando se procesa material para microscopía electrónica es necesario a veces hacerse una idea de qué zona del tejido vamos a cortar. Téngase en cuenta que el área de una sección para observar con el microscopio electrónico es muy pequeña. Además, el proceso de osmificación que ha de llevarse a cabo previamente a la inclusión acarrea el oscurecimiento del tejido, con lo que dificulta aún más la orientación de la muestra. Por ello es frecuente hacer secciones de 0,5 a 1 µm de grosor con el ultramicrotomo, denominadas secciones semifinas, para orientarnos en la muestra y seleccionar la zona a partir de la cual haremos las secciones ultrafinas. Los semifinos suelen tener áreas más grandes que las que posteriormente vamos a usar para la obtención de las secciones ultrafinas. El colorante usado para teñir secciones semifinas es normalmente el azul de toluidina, el cual puede infiltrase en la resina calentada en una plancha y llegar hasta el tejido (Figuras 3 y 4).


4. Fluorescencia
En la microscopía de fluorescencia, muy pocos colorantes tienen la posibilidad de ser observados con el microscopio de luz visible y con el de fluorescencia. Cuando se trabaja sólo con fluorescencia se utilizan sustancias que se unen normalmente al ADN nuclear, de manera que al teñir los núcleos tenemos una visión de cómo se organizan las células en el tejido. No es un colorante en sentido estricto, aunque aporte color a la muestra, sino que es una sustancia fluorescente, es decir, emite luz visible cuando es estimulada con una determinada longitud de onda. Una sustancia muy utilizada para marcar los núcleos celulares es el DAPI ( 4′,6-diamidino-2-phenilindol), que se une a regiones del ADN de doble candena ricas en adenina y timina. Emite una luz azul cuando se estimula con una longitud de onda de 405 nm. Normalmente se combina el DAPI con otras sustancias fluorescentes que emiten en color verde o en rojo, y que son estimuladas con otras longitudes de onda.

5. Microscopía electrónica
Contraste de ultrafinos. Aunque las secciones para microscopía electrónica se pueden observar directamente con el microscopio electrónico, se suelen tratar previamente con metales pesados en un proceso denominado contraste (Figuras 5 y 6), obteniendo así una imagen óptima de la ultraestructura celular. El contraste no es una tinción, puesto que no aporta color a la muestra, pero sí es un proceso habitual para poder observar los componentes ultraestructurales de la célula. Por ese motivo lo incluimos en este apartado. Téngase en cuenta que en la microscopía electrónica lo importante no es añadir sustancias coloreadas sino moléculas que puedan interferir en el camino de los electrones emitidos por el microscopio y que chocan contra la muestra. Los metales pesados unidos al tejido impedirán que pasen los electrones y por tanto se verá una zona negra en la pantalla fosforescente, mientras que en aquellas zonas de la célula donde no estén estos metales dejarán pasar los electrones y provocarán áreas luminosas en dicha pantalla. Por ello todas las imágenes originales de microscopía electrónica son en blanco y negro, aunque se puedan colorear posteriormente con un ordenador.


 Tinción
Tinción 