1. Semipermeabilidad
2. Fluidez
3. Heterogeneidad
- Internas
- Externas
- Curvatura, espesor
La composición química de las membranas hace que posean unas propiedades esenciales para las funciones que desempeñan en la célula. En esta página vamos a ver tres de ellas: semipermeabilidad, fluidez y heterogeneidad lateral.
1. Semipermeabilidad
Esta propiedad es consecuencia del ambiente hidrófobo interno de la membrana creado por las cadenas de ácidos grasos de los lípidos, difícil de cruzar por las moléculas con carga eléctrica neta. Esta capa hidrofóbica impide la libre difusión de moléculas y por tanto permite a las membranas crear compartimentos intracelulares con contenidos químicos específicos, y mantener separados el medio intracelular del extracelular. Sin embargo, la permeabilidad es selectiva, es decir, no todas las moléculas tienen las misma dificultad para cruzar la membrana por difusión pasiva. Las variables que más influyen a la hora de cruzar la membrana por difusión pasiva son la polaridad y el tamaño de la molécula. Así, moléculas pequeñas sin carga, por ejemplo el CO2, N2, O2, o moléculas con alta solubilidad en grasas, como el etanol, cruzan las membranas prácticamente sin dificultad por difusión pasiva (Figura 1). La permeabilidad de la membrana es menor para aquellas moléculas que tienen cargas eléctricas pero que son globalmente neutras (el número de cargas negativas iguala al de cargas positivas), como ocurre con el agua o el glicerol. Se podría pensar que el agua difunde libremente por las membranas pero no es así y por ello en determinadas membranas existen unas moléculas denominadas acuaporinas que facilitan el cruce de la membrana por parte del agua. Es menor aún la capacidad de atravesar la membrana para moléculas grandes con cargas pero globalmente neutras, como la glucosa. Sin embargo, es altamente impermeable a los iones y a las moléculas que tienen carga neta. Algunos valores del coeficiente de permeabilidad a través de membranas por difusión pasiva son: O2: 2.3 cm/s, CO2: 0,35 cm/s, H2O: 0,0034 cm/s, glicerol: 10 -6 cm/s, sodio y potasio: 10 -14 cm/s.

La desigual distribución de iones y moléculas entre ambos lados de la membrana es la base para la creación de los gradientes químicos y eléctricos. La medida de esa diferencia de concentración de cargas es lo que se llama potencial de membrana, que se usa para muchas funciones celulares, como por ejemplo la síntesis de ATP o la transmisión del impulso nervioso. La semipermeabilidad de la membrana también permite el fenómeno de la ósmosis, es decir, el flujo de agua hacia donde más concentración de solutos haya. Las células vegetales deben su crecimiento a este proceso. Como veremos más adelante, las moléculas que no cruzan las membranas libremente son interesantes para las células puesto que la variación de sus concentraciones a un lado u otro de la membrana puede actuar como señales o como herramientas. Para ello se han inventado proteínas transmembrana que permiten selectivamente el paso de estas sustancias de un lado al otro, unas para generar el gradiente y otras para romperlo en un momento y en unas condiciones determinadas. Por ejemplo, la contracción muscular se debe a una rotura puntual de un gradiente eléctrico.
La permeabilidad de las membranas depende de la composición de lípidos. Membranas más fluidas (ver más abajo) suelen ser más permeables, y viceversa. Por ejemplo, el aumento de la concentración de colesterol en la membrana plasmática suele hacer que las membranas aumenten su hidrofobicidad, y por tanto se vuelven más impermeables. Así, el aumento de la concentración de colesterol por encima del 30 % (es muy alta) hace que las membranas que forman la mielina sean muy buenas aislantes (muy impermeables) de los axones para la conducción del impulso eléctrico.
2. Fluidez
LLa fluidez es la capacidad de una molécula que forma parte de una membrana para desplazarse lateralmente por ella. Las membranas son fluidas, prácticamente son láminas de grasa, donde las moléculas se encuentran en un estado de líquido viscoso. Esto implica que, en teoría, las moléculas podrían difundir y desplazarse lateralmente por ella sin restricciones. Consideremos un glicerofosfolípido que está situado en la hemicapa externa de la membrana plasmática. Tendría dos posibilidades de movimiento: uno lateral donde se desplazaría entre las moléculas contiguas, y otro en el que saltaría a la hemicapa interna, movimiento denominado "flip-flop" (Figura 2). Los dos tipos de movimientos se han demostrado experimentalmente en las membranas artificiales pero el primero es mucho más frecuente que el segundo. Una molécula lipídica puede recorrer 30 micras en unos 20 segundos por difusión pasiva lateral, es decir, podría dar la vuelta a una célula de tamaño medio en aproximadamente un minuto. Sin embargo, los saltos entre hemicapas son muy infrecuentes y se estima que la posibilidad de que le ocurra a un lípido es de una vez al mes debido a que las cabezas polares de los lípidos se encuentran con la barrera de las cadenas de ácidos grasos. El colesterol posee, sin embargo, la capacidad de hacer movimientos "flip-flop" con relativa facilidad.

La fluidez de la membrana puede variar con la composición química de sus componentes. Así, generalmente, la menor longitud o la mayor cantidad de enlaces insaturados de las cadenas de ácidos grasos hacen que las membranas sean más fluidas. El colesterol también influye en la fluidez de la membrana, pero su efecto depende de las condiciones de temperatura y composición lipídica de la membrana. El colesterol tiene dos efectos: inhibir el paso a estado de gel sólido de la membrana, menos fluido, pero también disminuye la flexibilidad de los ácidos grasos de cadenas insaturadas. En general se puede decir que una mayor concentración de colesterol disminuye la fluidez de la membrana plasmática. Sin embargo, las bajas temperaturas disminuyen la fluidez de la membrana, y en estas condiciones el aumento de la concentración de colesterol favorece la fluidez. Las membranas internas de la célula como las del retículo tienen muy poco colesterol y son muy fluidas. Un efecto adicional del incremento de la concentración de colesterol es que aumenta la hidrofobicidad, es decir, las membranas se vuelven más impermeables.
La asimetría de las membranas, es decir, la diferente composición entre las dos hemicapas, puede generar también diferencias en la fluidez entre cada hemicapa. Así, se conocen dos fases en las cuales los lípidos se pueden empaquetar dependiendo de los tipos de lípidos que haya: líquido ordenado (menos fluido) y líquido desordenado (más fluido). La hemicapa externa de la membrana plasmática se cree más propensa a estar en la fase de líquido ordenado, mientras que su hemicapa interna en líquido desordenado.
Las células pueden alterar la fluidez de sus membranas modificando la composición química de éstas. Por ejemplo, en las bacterias la adaptación de la fluidez a las condiciones ambientales se debe sobre todo a cambios en la cantidad de saturación de los ácidos grasos y a la longitud de éstos. La variación en la concentración de glicerofosfolípidos como la fosfatidiletanolamina también pueden contribuir a regular la fluidez. Por ejemplo, algunos insectos no tienen capacidad de síntesis de esteroles, como el colesterol, y el que hay en sus membranas lo obtienen de la dieta. Estos animales pueden regular la fluidez de sus membranas variando la concentración de fosfatidiletanolamina.
Las mitocondrias deben crear una barrera suficientemente permeable en su membrana interna como para generar un gradiente de protones estable. Podrían hacerlo con un incremento de colesterol, que aumenta la hidrofobicidad de la membrana, pero esto disminuiría la fluidez, lo que parece ser necesario para la función de esta membrana. Para ello las mitocondrias cuentan con la cardiolipina, que es un fosfolípido muy insaturado, con lo que aumenta la hidrofobicidad evitando una excesiva disminución de la fluidez.
3. Heterogeneidad lateral
Debido a la propiedad de la fluidez podría pensarse que las moléculas están distribuidas al azar en la membrana y que por tanto ésta sería homogénea en cuando a composición molecular en cualquier lugar de su superficie. Esto no es así y hay diversas restricciones a las movilidad lateral de las moléculas que hacen que la membrana tenga dominios con composiciones moleculares diferentes, es decir, sea heterogénea. En las células no polarizadas, y si muestreamos a escalas superiores a los 200 nm, la membrana plasmática parece ser homogénea, aunque nos encontremos con dominios de varias micras de tamaño, tales como las sinapsis de las células inmunitarias o los complejos de unión. Pero a escalas inferiores a los 200 nm es cuando aparecen más heterogeneidades. Los microdominios de membrana se calcula que son de unos 60 a 100 nm de tamaño. Así, los lípidos y las proteínas se mueven más frecuentemente en áreas restringidas de 60-200 nm, y se confinan en estos compartimentos durante milisegundos antes de saltar al área adyacente. Inicialmente, a esto se le denominó difusión saltatoria. Se sabe que en la membrana hay moléculas que prácticamente están fijas y otras que tiene libertad total de traslación lateral y de rotación (con el eje de rotación perpendicular a la superficie de la membrana).
Las restricciones al desplazamiento lateral de moléculas pueden ser causadas por diversos mecanismos como la interacción directa de moléculas de la membrana con moléculas del citoesqueleto o la matriz extracelular, interacciones moleculares entre las propias moléculas de la membrana, cambios de densidad (menor fluidez local), concentración desigual de cargas eléctricas, grado de curvatura de la membrana o espesor de la misma (Figura 3).
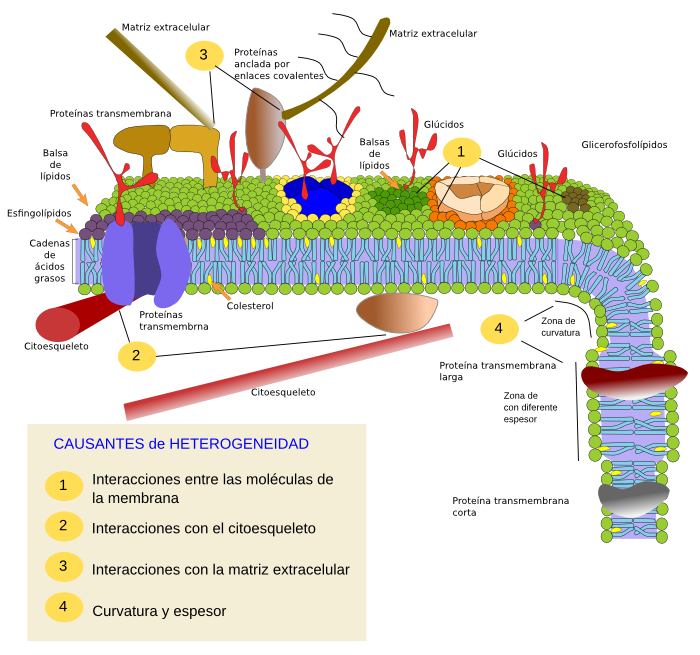
Interacciones moleculares internas
Un tipo de restricción al movimiento de las moléculas en las membranas de las células se debe a las interacciones y asociaciones moleculares entre las propias moléculas de las membranas (Figura 4). Esto afecta tanto a las proteínas como a los lípidos, y crea dominios, es decir, distribución heterogénea de moléculas en las membranas. Según los tipos de moléculas que los componene, estos dominios pueden tener diferente densidad: sólido, líquido ordenado o líquido desordenado. El estado de líquido desordenado es el mayoritario en la membrana, que es el más fluido.

Los esfingolípidos y el colesterol se pueden asociar entre sí espontáneamente haciendo que su movilidad disminuya y por tanto conformen una región membranosa más densa que el resto, como si de una balsa en un mar se tratara. Se cree que estas asociaciones, denominadas balsas de lípidos ("lipid rafts"), son muy abundantes y dinámicas, y hacen que las membranas celulares sean en realidad un mosaico de dominios más densos que viajan entre los glicerofosfolípidos, más fluidos. Estas balsas serían muy pequeñas, entre 10 y 200 nm, muy dinámicas en su formación y desaparición, pero también en los cambios de tamaño, en la fusión entre ellas y en su división. Hay experimentos que apoyan la idea de que ciertas proteínas tendrían mayor apetencia por estas balsas y por tanto viajarían en el interior de ellas. Este confinamiento de proteínas en dominios celulares es importante puesto que permitiría agrupar o segregar conjuntos de proteínas que favorecerían o no el inicio de cascadas de señalización intracelulares. Además, se postula que la alta concentración de ciertos tipos de lípidos en dichas balsas crea un ambiente químico propicio para determinadas reacciones químicas o interacciones moleculares. Por ejemplo, se cree que la infección de los linfocitos por parte del virus del SIDA se ve favorecido por la existencia de dichas balsas de lípidos, que facilitarían el anclaje del virus a la célula. En cualquier caso tales dominios de esfingolípidos y colesterol sólo se han postulado para la hemicapa externa de la membrana plasmática, y también se propone su existencia en las membranas de los orgánulos celulares donde algunas funciones del propio orgánulo estarían segregadas en distintos dominios de sus membranas.
En la hemicapa interna de la membrana plasmática se forman otros microdominios provocados por interacciones electrostáticas entre proteínas que tienen regiones citosólicas básicas y/o cationes divalentes con lascabezas polares de los lípidos cargadas negativamente. En la hemicapa interna se producen agrupaciones de lípidos fosfatidilinositol en torno a proteínas. Estas agrupaciones se pueden controlar mediante la modificación de sus cargas eléctricas añadiendo o quitando fosfatos de sus cabezas polares del fosfatidilinositol. Hay otro tipo de agregación menos conocida formada por el fosfatidil inositol 2-fosfato y el colesterol, los cuales forman agregados muy pequeños en la hemicapa citosólica de la membrana plasmática. Estos microdominios parecen influir en el andamiaje proteico intracelular.
Aunque tradicionalmente se ha pensado que la hemicapa externa y la interna de la membrana son independientes a la hora de distribuir sus heterogeneidades lipídicas respectivas, hay evidencias que pueden influirse entre sí. Una manera es por la presencia de proteínas transmembrana que afectan simultáneamente a ambas hemicapas, pero también puede ocurrir sin la intervención de proteínas. .La longitud de las cadenas de algunos ácidos grasos, como las de algunos esfingolípidos, pueden ser de hasta 24 átomos de carbono (normalmente son 18), con lo que se insertarían entre los ácidos grasos de los lípidos de la otra hemicapa afectando a la distribución lipídica de esta última. Otra manera de sincronizar hemicapas es mediante agrupaciones de lípidos de cadena larga en una capa, en la otra suele haber otros de cadena corta para homogeneizar el espesor de la membrana.
Al igual que el caso de los lípidos, también se han encontrado “nano-grupos” de proteínas que viajan juntas en el plano de la membrana. Por ejemplo, las proteínas integrales o asociadas a la membrana pueden interaccionar entre sí y ensamblarse en estructuras macromoleculares que favorezcan la transmisión de señales, reconocimiento celular, activación enzimática, movimiento celular, etc. También hay proteínas multiméricas que sólo son activas cuando tienen todas sus subunidades asociadas entre sí. Por ejemplo, el receptor de la insulina está compuesto por cuatro subunidades.
Interacciones externas con el citoesqueleto y la matriz extracelular
Las proteínas integrales de membrana también tienen la posibilidad de difundir lateralmente de forma libre. Sin embargo, se ha comprobado que tienen numerosas restricciones a la movilidad, principalmente por culpa de las interacciones de sus dominios intra y extracelulares con moléculas del citoesqueleto y de la matriz extracelular, respectivamente (Figura 5). Estas interacciones pueden anclar por tiempos más o menos prolongados las proteínas de membrana a lugares concretos de la superficie celular. Otra posibilidad de restricción es crear territorios a modo de cercados, donde las cercas son los filamentos del citoesqueleto en la cara citosólica de la membrana plasmatica, de manera que las proteínas queden confinadas a regiones pequeñas delimitadas por el citoesqueleto.

En las proximidades de la cara citosólica de la membrana plasmática hay un entramado de proteínas pertenecientes al citoesqueleto (actina y miosina) que a través de proteínas adaptadoras interacciona con las proteínas de membrana y condiciona su movilidad. Estas proteínas inmovilizadas, aunque sea temporalmente, pueden actuar a su vez como barreras a la difusión de otras moléculas no ancladas, es decir, como postes que impiden la difusión a otras moléculas. Estas interacciones sirven no sólo para inmovilizar moléculas o agregados de moléculas, sino también para moverlas a determinadas regiones de la membrana. Un ejemplo claro de este tipo de movimiento se da en la membrana de los cilios, que tienen un juego de proteínas característico gracias a las interacciones con el citoesqueleto. Las interacciones con el citoesqueleto son importantes puesto que cuando se desorganiza el citoesqueleto la membrana tiende a ser mucho más homogénea.
Las células tienen otros mecanismos para confinar proteínas a determinados dominios celulares. Por ejemplo, en las células epiteliales del digestivo ciertos transportadores y enzimas están localizados sólo en la zona apical y otros en la basal gracias al cierre a modo de cinturón que realizan las uniones estrechas. Tal asimetría es esencial para el funcionamiento de la célula epitelial.
Las interacciones en la superficie externa de la membrana son con moléculas de la matriz extracelular, tales como colágeno, proteoglicanos, ácido hialurónico y otras.
Curvatura y espesor
Curvar una membrana es otra manera de crear dominios. Esta curvatura puede ser el proceso inicial para la formación de una vesícula, la extensión de una expansión celular, el cambio o crecimiento de un orgánulo, o simplemente un pliegue que actúa como barrera a las difusión lateral de moléculas.
La maquinaria necesaria para curvar una membrana requiere a su vez ser reclutada a un dominio de membrana previo. Determinadas composiciones lipídicas o zonas con diferente carga eléctrica son sitios de atracción para esta maquinaria. Los fosfoinosítidos son lípidos que participan en este reclutamiento, particularmente PIP2 y PIP3. Son apropiados para esto puesto que su cabeza puede cambiar en carga y estructura mediante modificaciones químicas locales. Estos lípidos son a su vez mantenidos en el sitio por afinidad con las proteínas reclutadas. La creación inicial de un dominio para curvar una membrana ocurre también con la fostatidilserina, la cual, cuando cambia de hemicapa por acción de las flipasas, es capaz de ayudar a generar curvatura, y es retenida por proteínas como la caveolina.
Los microdominios de lípidos atraen a las proteínas que realmente curvan a las membranas de manera efectiva (Figura 6). Hay proteínas especializadas en crear curvatura de membranas. El dominio proteico BAR (Bin/amphyphysin/Rsv161) es uno de ellos. Lo hace de dos maneras: mediante la creación de un andamiaje curvado sobre el que descansa la membrana o mediante inserciones de secuencias de aminoácidos en la membrana a modo de cuñas. Por ejemplo, las caveolinas generan curvatura para formar caveolas, las tetraspaninas generan túbulos en las membrana, los ESCRT son responsables en los endosomas de crear las vesículas de los cuerpos multivesiculares, etcétera. Por último, los filamentos de actina son unas auténticos curvadores de membranas mediante polimerización, mediante la cual empuja a la membrana plasmática hacia afuera creando expansiones celulares. Muchas de las proteínas capaces de curvar la membrana son también unas activadoras de la polimerización de filamentos de actina.

Otros dominios físicos de las membranas son regiones de diferente espesor o altura (Figura 7). Se forman por proteínas transmembrana que tienen del dominio hidrofóbico más largo de lo habitual y por tanto se acomodan mejor en la membrana cuando se rodean de lípidos con cadenas de ácidos grasos largos. Estas agrupaciones de lípidos y proteínas crean áreas de mayor grosor que excluyen a otras proteínas con secuencias de aminoácidos hidrofóbicos más cortas o a lípidos con cadenas de ácidos grasos con menos átomos de carbono.

-
Bibliografía ↷
-
Bibliografía
Honigmann A, Pralle A. 2016. Compartmentalization of the cell membrane. Journal of mollecular biology. 428: 4739-4748.
Jacobson K, Liu P, Lagerholm BC. 2019. The lateral organization and mobility of plasma membrane components. Cell. 177: 806-819. DOI: 10.1016/j.cell.2019.04.018.
Jarsch IK, Daste F, Gallop JL. 2014. Membrane curvature in cell biology: an integration of molecular mechanisms. Journal of cell biology. 214: 275-387.
Nicolson GL. 2014. The Fluid—Mosaic Model of Membrane Structure: Still relevant to understanding the structure, function and dynamics of biological membranes after more than 40 years. Biochimica et biophysica acta. 1838: 1451-1466.
Subczynski WK, Pasenkiewicz-Gierula M, Widomska J, Mainali L, Raguz M. 2017. High cholesterol/low cholesterol: effects in biological membranes: a review Cell biochemstry and biohysic. https://doi.org/10.1007/s12013-017-0792-7.
-
 Glúcidos
Glúcidos