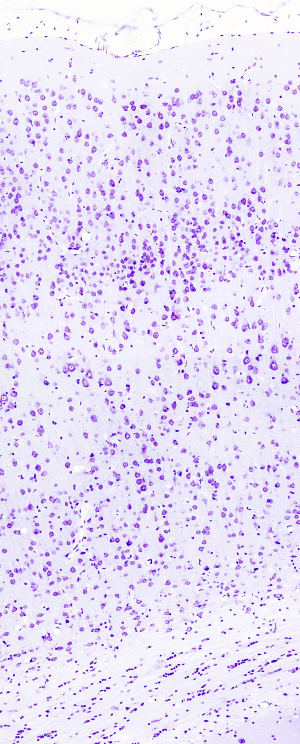
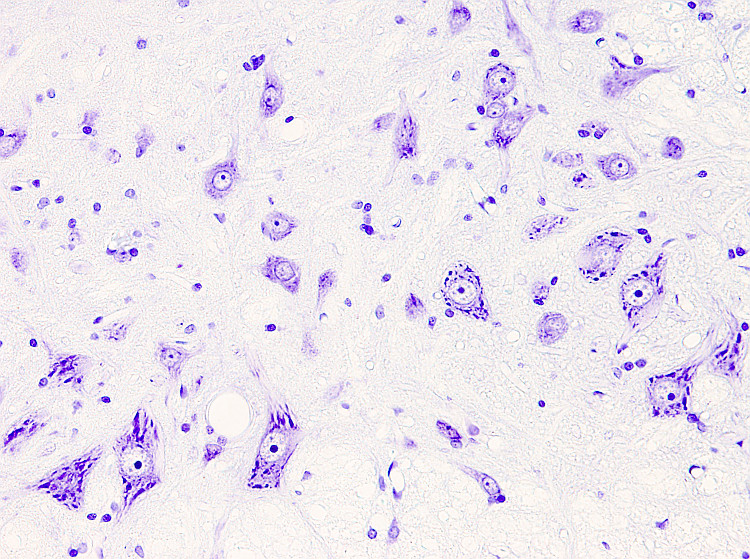
La tinción de Nissl es muy usada en tejido nervioso, sobre todo en encéfalo y médula espinal, para estudiar la organización de las neuronas en núcleos y capas, aunque sirve para cualquier tejido. Tiñe estructuras ácidas como el núcleo y los cúmulos de ribosomas. El colorante en el que se basa la tinción es normalmente el azul de toluidina o el violeta de cresilo. El más usado es el violeta de cresilo, que es el que se describe más abajo.
En el citoplasma de las neuronas aparecen unas estructuras fuertemente teñidas con esta tinción denominadas cuerpos de Nissl, que se corresponden con acumulaciones de retículo endoplasmático rugoso. Aquí se tiñen el ARN ribosómico y el ARN mensajero que se está traduciendo.
Procedimiento
Partimos de muestras fijadas con formaldehído (fijador Bouin o paraformaldheído al 4%) e incluidas en parafina.
1.- 2x10 min en xileno para desparafinar
2.- 2x10 min en etanol 100º
3.- 10 min en etanol 96º
4.- 10 min en etanol 80º
5.- 10 min en etanol 50º
6.- 5 min en H2O destilada
7.- 5-10 min solución de violeta de cresilo (CAS: 10510-54-0) al 0.1 %.
Hay varias maneras de preparar el violeta de cresilo:
a) 0.1 g de violeta de cresilo en 100 ml de agua destilada. Justo antes de usar se añaden unas gotas de ácido acético glacial y se filtra.
b) 0.1 g de violeta de cresilo en 100 ml de agua destilada, más 0.25 ml de ácido acético glacial. Disolver a 60 ºC hasta la disolución del violeta de cresilo. Guardar en oscuridad y filtrar antes de usar.
c) Tampón acetato: Solución A: 0.6 ml de ácido acético en 100 ml de agua destilada; solución B: 1.36 g de acetato sódico en 100 ml de agua destilada. Mezclar las soluciones A y B en una proporción de 9 a 1 (9 de A y 1 de B) y ajustar el pH a 3.7. Mezclar violeta de cresilo al 1 % en agua destilada y tampón acetato en una proporción de 1:1. Filtrar y usar.
En el caso de que sean secciones gruesas se puede usar la solución con el colorante calentada a 37 ºC.
8.- Lavado rápido en H2O destilada.
9.- Diferenciar en etanol de 96º durante varios minutos y comprobar el proceso con el microscopio.
10.- 2x10 min en etanol 100º
11.- 2x10 min en xileno
15.- Montado con medio de montaje.
Resultados
Núcleos: rosa - violeta.
Retículo endoplasmático rugoso: púrpura.
Consejos
La calidad de la tinción depende del tiempo de diferenciación durante la deshidratación final, luego los tiempos en estos alcoholes afectarán al resultado final.
Si permanecen en el tejido gotas de lípidos o mielina (cortes de vibratomo, microtomo de congelación o de criostato), y no se quiere que interfieran con la tinción de los cuerpos celulares, las secciones pueden deshidratar en etanol creciente y volver a hidratar para eliminar tales lípidos.
Productos
Xileno
Etanol de 50º, 70º, 80º, 90º, 96º y 100º
Violeta de cresilo (CAS: 10510-54-0)
Ácido acético
Acetato sódico
H2O destilada
Medio de montaje
Material
Cubetas de tinción
Filtro de papel
Probeta
Botes
Cesta para portas
Cubreobjetos